高二月考化学试题
(本卷考试时间:120分钟 满分:150分 )
有可能用到的原子量: H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 P-31
S-32 Cl-35.5 Fe-56 Cu-64
一、选择题(本题共有9小题,每题只有一个正确答案)
1、在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量1mol/L盐酸反应时,速率最快的是
A、镁 B、铝 C、锌 D、铁
2、在含有1mol HNO3和2mol H2SO4的混合稀液中,加入1.5mol Cu,加热,充分反应后产生的气体的体积在标准状况下约为
A.5.6L B.11.2L C.22.4L D.44.8L
3、在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色
A、变蓝色 B、变深 C、变浅 D、不变
4、下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是
A.氨气,Al2(SO4)3溶液 B.Zn,FeCl3溶液
C.稀盐酸,Na2CO3溶液 D.铁,稀硝酸
5、pH值相同的四种一元酸A、B、C、D的溶液各20 mL,与过量Mg充分反应后,产生氢气的质量是D>C>A=B。下列说法正确的是:
① D的酸性最强 ② A与B的酸性最强且彼此相当
③ 反应后原D溶液的PH最大 ④ 反应后原A和B溶液的PH最大
⑤ 反应前D溶液的物质的量浓度最大 ⑥反应前四种溶液的物质的量浓度一样大
A.②③⑤ B.①④⑥ C.②④⑤ D.①③⑤
6、在一密闭容器中,等物质的量的A和B发生如下反应:A(g)+2B(g) ![]() 2C(g),一段时间后反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是
2C(g),一段时间后反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是
A、40% B、50% C、60% D、70%
7、镁和铝都是较活泼金属,下列叙述不正确的是
①镁易溶于冷水,而铝难溶于冷水 ②常温下镁难溶于浓硫酸,而铝易溶于浓硫酸
③镁溶于碱液,而铝难溶于碱液 ④分别电解熔融MgO、Al Cl3得单质Mg、Al
⑤镁铝合金的熔点高于镁或铝的熔点
A.①②③⑤ B.①②④⑤ C.②③④⑤ D.全部
8、把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生如下反应:
3 X (g)+Y (g) ![]() n Z (g)+2 W (g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol/(L·min)。上述反应中Z气体的化学计量数n的值是
n Z (g)+2 W (g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.01mol/(L·min)。上述反应中Z气体的化学计量数n的值是
A、1 B、2 C、3 D、4
9、物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3,按c(CO32-)由小到大排顺序正确的是
A、⑤<④<③<②<① B、③<⑤<②<④<①
C、③<②<⑤<④<① D、③<⑤<④<②<①
二、选择题(本题共有10小题,每题有一个或两个正确答案)
10、反应3Fe(s)+4H2O(g)
![]() Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A、增加Fe的物质的量
B、将容器的体积缩小一半
C、保持体积不变,充入Ne使体系压强增大
D、压强不变,充入Ne使容器的体积增大
11、对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法正确的是
A、它们的c(H+)不相同
B、各用水稀释一倍后,pH比较:盐酸<醋酸
C、分别和同浓度的氢氧化钠溶液反应至pH=7,所用氢氧化钠溶液的体积不同
D、各与足量的锌粒充分反应,产生H2的量不同
12、下列离子方程式中正确的是
A.碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.Cu片插入FeCl3溶液中:3Cu+2Fe3+=3Cu2++2Fe
C.标准状况下,2.24L氯气通入100mL 4 mol / L的FeBr2溶液中:
2Fe2++ Cl2 2Fe3++2Cl-
D.去膜后的铝片投入NaOH溶液中:2Al+2H2O+2OH-![]() 2AlO
2AlO![]() +3H2↑
+3H2↑
13、某无色透明的溶液中,水电离出的c(OH—)=10—13mol/L。下列各组离子可以在此溶液中大量共存的是
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
14、在一定的温度和体积下,在一密闭容器之中加入2 mol A和1 mol B,发生如下反应:2A(g)+B(g) ![]() 3C(g)+D(g) 达平衡时测得C的浓度为W mol / L。若保持一定的温度和体积,按下列四种配比作起始物,达平衡时,C的浓度小于W mol / L的是
3C(g)+D(g) 达平衡时测得C的浓度为W mol / L。若保持一定的温度和体积,按下列四种配比作起始物,达平衡时,C的浓度小于W mol / L的是
A.4 mol A+2 mol B B.3 mol C+1 mol D+1 mol B
C.3 mol C+1 mol D D.3 mol D +1 mol C
15、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O ![]() Fe(OH)2+2H+,往该溶液中滴加适量浓盐酸,发生的变化是
Fe(OH)2+2H+,往该溶液中滴加适量浓盐酸,发生的变化是
A. 盐酸中的H+抑制了Fe2+水解使平衡向逆反应方向移动
B. 溶液由浅绿色变为深绿色
C.盐酸中的H+与Fe(OH)2作用使平衡向正反应方向移动
D. 溶液由浅绿色变为黄色
16、有一铁的氧化物样品,用5 mol/L盐酸100 mL恰好完全溶解,所得溶液还能吸收标况下的氯气1.12 L,Fe2+全部被氧化为Fe3+,则该氧化物的化学式可表示为:
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
17、下列各溶液中,微粒的物质的量浓度关系正确的是:
A.0.1 mol/L的(NH4)2SO4溶液中:c (SO42– ) > c (NH4+ ) > c (H+)> c (OH–)
B.0.2 mo1/L的Na2CO3溶液中:c (OH–)= c (HCO3–) + c (H+) + 2 c (H2CO3)
C.0.1 mol/L的NH4Cl溶液与0.05 mol/L的NaOH溶液等体积混合:
C (Cl–) > c (Na+ ) > c (NH4+ ) > c (OH–) > c (H+)
D.c (NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液以及(NH4)2Fe(SO4)2溶液:
C[(NH4)2Fe(SO4)2]< c [(NH4)2SO4] < c [(NH4)2CO3]
18、在容积一定的密闭容器中,可逆反应A2(g)+ B2(g)![]() xC(g)
符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)
符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
19、弱电解质的电离存在着电离平衡,当达到电离平衡时,已电离的分子数占弱电解质总分子数的百分比称为电离度。在25℃时,pH=4的盐酸和氯化铵溶液中,水的离子积(Kw)和电离度(HCl和NH4Cl分别用αA和αB表示)的叙述正确的是
A、Kw相等,αB ==αA B、Kw不等,αB ==11αA
C、Kw相等,αB ==![]() αA D、Kw相等,αB ==
αA D、Kw相等,αB ==![]() αA
αA
三、填空题
20、用中和滴定法测定某烧碱的纯度。
⑴配制待测液:将1.7g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所用的主要仪器有________________________________________。
⑵滴定:①盛装0.20mol/L盐酸标准液应该用_______式滴定管,滴定管洗涤干净的标准是________________________________________________________________________。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________,滴定终点时,锥形瓶中的溶液的颜色变化是(选序号)_________。
A、由黄色变为红色 B、由黄色变为橙色 C、由浅红色变为无色 D、由无色变为红色
③有关数据记录如下:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
⑶纯度计算:
NaOH溶液的浓度为______________mol/L,烧碱样品的纯度为____________。
⑷对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果_________________。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果_________。
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_________。
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果_________________。
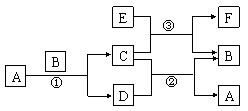 21、下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质。反应①②是置换反应,反应①②③均在高温下进行。A在常温下为液态,C有磁性,F既能溶于NaOH又能溶于HCl。
21、下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质。反应①②是置换反应,反应①②③均在高温下进行。A在常温下为液态,C有磁性,F既能溶于NaOH又能溶于HCl。
⑴A的电子式
⑵写出反应①的化学方程式
⑶写出E与浓强碱液反应的离子方程式
⑷C、E的混合物在工业上用钢轨焊接,写出反应③的化学方程式:
22、在25℃时,1mol·L-1的①(NH4)2SO4 ②(NH4)2CO3 ③(NH4)2Fe(SO4)2 ④NH4HSO4 ⑤NH4Cl的溶液中,c(NH4+)由大到小的顺序为
23、某化工厂生产中要用到一种无色、可溶于水的晶体——铝铵矾,该晶体是一种复盐,其主要化学成分是硫酸铝铵——NH4Al(SO4)2,向该盐的浓溶液中加入浓KOH溶液,将发生一系列变化,已知NH4+和AlO2-不能大量共存,会发生反应:
NH4++ AlO2-+H2O==Al(OH)3↓+NH3,试求:
A.硫酸铝铵在水中电离的方程式:
B.在逐渐加入浓KOH溶液的过程中,产生的现象依次是:①溶液中出现白色沉淀,白色沉淀量逐渐增多 ②有刺激性气味的气体放出 ③白色沉淀量逐渐减少,白色沉淀完全消失,请依次写出滴入KOH溶液过程中发生的化学反应的离子方程式:
① ②
③
24、恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2+3H2 ![]() 2NH3
2NH3
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成amol NH3,这时N2的体积分数为 。
(2)若开始时放入![]() N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为
N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为![]() mol和3 amol,则
mol和3 amol,则![]() =
,
=
,![]() 。平衡时H2的物质的量是 (选填一个编号)。
。平衡时H2的物质的量是 (选填一个编号)。
A.大于6 mol B.等于6 mol
C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 。
(3)若在(2)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
25、在250C,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是 (填“强酸”或“弱酸”),理由是
四、计算题(本题共有2小题)
26、现有100 mL 1 mol·L-1的碳酸钠溶液和100 mL 1.25 mol·L-1的盐酸.
(1)若将碳酸钠溶液逐滴滴加到盐酸中,求收集到的CO2的体积;
(2)若将上述盐酸逐滴加入到碳酸钠溶液中,反应完全后,CO2在溶液中的浓度为0.04 mol·L-1,求收集到的CO2在标准状况下的体积(气体体积都在标准状况下测定,溶液体积变化忽略不计)。
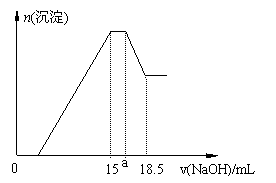 27、某同学将一定量的Al粉和Fe粉的混合物加入到100mL稀硝酸中,搅拌使其充分反应后,发现Al粉和Fe粉全部溶解而反应过程中无任何气体放出。经查阅资料,已知金属与硝酸反应时,可得到+4、+2、0或-3价的氮的化合物。为探究反应原理,该同学在反应结束后的溶液中,逐渐加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图(图中a点坐标为16.5)所示。分析图示信息后回答:
27、某同学将一定量的Al粉和Fe粉的混合物加入到100mL稀硝酸中,搅拌使其充分反应后,发现Al粉和Fe粉全部溶解而反应过程中无任何气体放出。经查阅资料,已知金属与硝酸反应时,可得到+4、+2、0或-3价的氮的化合物。为探究反应原理,该同学在反应结束后的溶液中,逐渐加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图(图中a点坐标为16.5)所示。分析图示信息后回答:
(1)混合物中Al粉的质量是多少?
(2)判断上述反应中的还原产物,并求被Al、Fe还原的HNO3的物质的量。
(3)混合物中铁粉的物质的量是多少?

高 二 月 考 化 学 答 题 卷
(本卷考试时间:120分钟 满分:150分 )
有可能用到的原子量: H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 P-31
S-32 Cl-35.5 Fe-56 Cu-64
一、 选择题(本题共有9小题,每题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
二、选择题(本题共有10小题,每题有一个或两个正确答案)
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、填空题
20、(1)
(2)①
②
(3)
(4) ① ② ③ ④
21、(1)
(2)
(3)
(4)
22、
23、A
B ①
②
③
24、(1)
(2)
(3)
25、
四、计算题(本题共有2小题)
26、
27、