高二周练化学试题
一 选择题(每题只有一个正确答案)
1.关于工业生产的下列叙述中,不正确的是
A.工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.工业上用离子交换膜法电解饱和食盐水制烧碱
D.工业上采用电解熔融氯化铝的方法制取金属铝
2.旨在限制全球温室气体排放量的《京都都议定书》于2005年2月16日正式生效。为降低
我国二氧化碳气体排放量(居世界第二)的下列措施中,你认为不切合实际的是 ( )
A.停止使用产生二氧化碳气体的化学能
B.充分利用太阳能
C.合理、安全开发利用氢能、核能
D.因此制宜开发利用风能、水能、地热能、潮汐能
3.下列说法中,正确的是 ( )
A.离子晶体的组成中一定有金属元素
B.晶体中有阳离子就一定有阴离子 。
C.由原子组成的晶体可以是原子晶体,也可以是分子晶体
D.离子晶体不可能存在非极性共价键
4.100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
5.物质世界中有很多变化是由物理变化造成的。以下变化或过程就属于物理变化的是
A.激光法蒸发石墨得C60 B.渗析法净化氢氧化铁胶体
C.鸡蛋白遇浓硝酸显黄色 D.直流电通过氯化钠水溶液
6.下列有关比较中,大小顺序排列错误的是
A.物质的熔点:石英>食盐>冰>汞
B.热稳定性:PH3>H2S>HBr>NH3
C.结合质子的能力:CO32—>CH3COO->SO42—
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
7.能说明Al的金属活动性比Cu强的事实是
A.以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解
B.常温下将铝和铜用导线连接放入到稀盐酸溶液中,铝为负极
C.与氯气反应时,铝失去3个电子,而铜失去2个电子
D.常温下,铝在浓硝酸中钝化而铜不发生钝化
8.下列说法或表示方法中,正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→ C(金刚石):△H=+1.19 kJ/mol可知,金刚石较石墨稳定
C.在稀溶液中,H+(ag) + OH一(ag) = H20(1);△H=一57.3KJ/mol。若将含0.5mol
H2S04的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa 25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+02(g)==2H2O(l);△H = 一285.8 kJ/mol
二 选择题(每题有一到两个正确答案)
9.测试空气中污染物H2S气体含量的吸收剂,既可选用CuS04溶液,也可选用浓溴水。有关化学反应的原理为:
①Cu2+ + H2S= CuS↓ + 2H+; ②Br2+H2S=S↓ +2H+ + 2Br一。
下列说法中,正确的是 ( )
A.反应①②中,-2S 都被氧化,转化进入沉淀
B.反应①②都使反应物的某些离子浓度减小
C.以CuS04溶液为吸收剂,吸收前后溶液的导电性变化明显
D.吸收很高浓度H2S,宜选用浓溴水作吸收剂
10.下列离子方程式正确的是
A.碘化亚铁溶液中通人少量氯气C12+2Fe2+=2C1一 + 2Fe3+
B.硫酸氢钠溶液与少量氢氧化钡溶液反应
2H+ + SO42- + Ba2+ + 20H一 =BaS04 ↓ + 2H2O
C.将等物质的量的C12和SO2同时通入水中
C12+SO2+2H20=S042-十 2Cl一 + 4H+
D.金属铝溶于氢氧化钠溶液Al +2OH一 =A!O2- + H2O
11.用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuS04溶液做电解液电解精炼铜,当电路中有2 mol e一通过时,下列结论中正确的是 ( )
A,阴极质量增加65 g B.阳极质量减少216 g
C.阳极质量减少大于64 g D.电解质溶液的质量增加64 g
12.阿伏加德罗常数约为6.02×1023mol-1。,下列叙述中正确的是 ( )
A.在含1 mol C02的干冰晶体中含有C=O键的数目为2×6.02×1023
B.工业生产硫酸生成1 mol H2S04时实际投入的S02分子数为6.02×1023
C.78 g Na202与足量水充分反应,转移的电子数为2×6.02×1023
D.以铝、稀H2S04、NaOH溶液制备Al(OH)3,若消耗nmol H+,则消耗OH一的数目为n×6.0×1023
13.下列各组离子在相应的条件下可以大量共存的是
A.在碱性溶液中:CO32—、K+、C1—、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2+、Na+、SO42—
C.在c(H+)/c(OH—)==1×1013的溶液中:NH4+、Ca2+、C1—、K+
D.在中性溶液中:Fe3+、S2—、NO3—、A13+
14.常温时,将V1 mL cl mol·L—1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是
A.若混合溶液的pH=7,则c1V1=c2V2
B.若V1=V2,c1=c2,则混合液中c(NH4+)=c(Cl—)
C.若混合液的pH=7,则混合液中c(NH4+)=c(Cl—)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
15.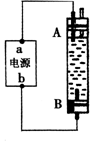 某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是
某同学设计了一种电解法制取Fe(OH)2的实验装置(如右图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是
A.电源中“a”为正极,“ b”为负极
B.电解池中的电解液可以是NaOH溶液但不能是NaCl溶液
C.A、B两端都必须使用铁作电极
D.B电极发生的反应:2H2O+2e-=H2↑+2OH-
![]() 16.已知某温度下:N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol。
16.已知某温度下:N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol。
恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3molH2,B中通入
0.5molN2、1.5molH2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是
A.A中吸热92.4kJ B.B中放热46.2kJ
C.A中热量变化值大于B中的2倍 D. A中热量变化值等于B中的2倍
17.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,②纯水在25℃和80℃时的pH,③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量,④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数,⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,⑥耐火材料MgO和CaO的熔点,⑦H-和H+离子半径,⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.①②⑥⑦
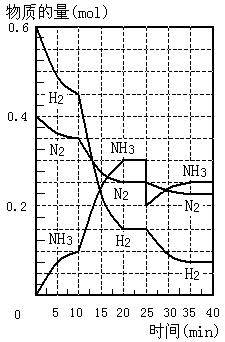 18.500℃、20Mpa时,将H2和N2置于一容积为
18.500℃、20Mpa时,将H2和N2置于一容积为
2L的密闭容器中发生反应。反应过程中H2、N2
和NH3物质的量变化如图所示,下列说法正确
的是
A.反应开始到第一次平衡时,N2的平均反应速
率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至
20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟
时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后
NH3的体积分数比原平衡小
19.已知某溶液中存在OH―、H+、NH4+和 Cl― 四种离子,其浓度大小有如下关系:
①c(Cl―)> c(NH4+)> c(H+)> c(OH―)
②c(NH4+)= c(H+)>c(Cl―) > c(OH―)
③c(Cl―)= c(NH4+)且c(OH―)= c(H+)
④c(OH―)> c (H+)> c(Cl―)> c(NH4+)
⑤c(Cl―)> c(H+)> c(NH4+)> c(OH―)
其中可能正确的是
A.①④ B.②⑤
C.③④ D.①③⑤
20.假设SiO2 原子晶体中Si原子被Al原子取代,不足的价数由K原子补充。当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6
C.KAlSi3O8 D.KAlSi4O10
|
高二周练化学试题
三 非选择题
21.(14分) 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1) 称取5.0g该氢氧化钠固体样品,配成500mL溶液备用。
(2)将标准盐酸装在25.00mL酸式滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。(选填编号)
A.(1)中,转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读滴定管开始时仰视,读终点时俯视
22.
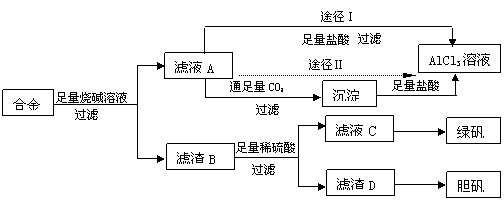 |
(12分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),拟用如下实验方案:
试回答下列问题:
(1)实验中多次进行过滤操作,过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是 ___________。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 __________________ 。
(4)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
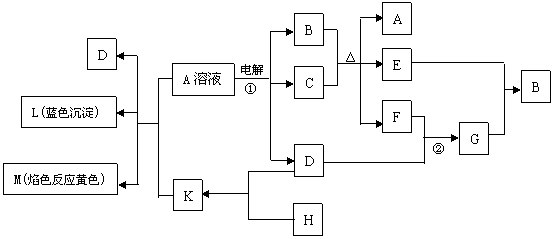 |
23.(10分) 下列物质的相互转化关系中,已知B是基础化学工业的重要产品,它的消费量常被视为一个国家工业水平的一种标志,K是含非极性键的离子化合物,E是无色无味的液体。试回答:
(1)G的化学式为___________________,K的电子式为_____________________。
(2) 反应①的离子方程式____________________________________________。
(3) 反应②工业上称F为接触氧化反应,根据化学平衡理论和下表F转化率的实验数据,考虑综合经济效益,你认为提高F转化率工业上应采取的反应条件及有效措施是
_______________________________________________________ 。
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa | |
| 400 ℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 ℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 ℃ | 73.7 | 85.8 | 89.5 | 96.4 |
24.(13分)有资料报道:铁酸钠(Na2FeO4)是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+离子,使用该物质可代替Cl2和Al2(SO4)3。
(1)用废铁屑制Fe2O3 。向有铁锈的废铁屑中加入稀硫酸,至铁屑全部溶解。再通过系列化学过程得到Fe2O3 。写出向有铁锈的废铁屑中加入稀硫酸过程中的离子反应方程式。
______________________________________________________________ ______________________________________________。
(2)制备铁酸钠。氧化铁在碱性溶液中与硝酸钠反应制得铁酸钠。
Fe2O3 +NaNO3 +NaOH → Na2FeO4+NaNO2 +H2O (未配平)
当反应物中含有1.4 mol Na+ ,上述反应恰好完全进行时,电子转移总数为_______NA。
(3) 制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中①NaCl ②NH4Cl ③KMnO4 ④浓硫酸,能使NaNO2转化为N2(不引起二次污染的)的是______(选填试剂编号),离子反应方程式____________________________________。
25.(9分)已知由硝酸银和硝酸铜组成的100mL混合溶液中,c(NO3-)=2mol/L。现往其中加入一定量的铝粉,充分反应后过滤,将滤纸上的沉淀干燥后称重为12.4g。将此沉淀加入稀盐酸中无气体产生。滤液中滴入NaCl溶液无现象。后加入过量的稀NaOH溶液得到沉淀。过滤、加热、冷却、称重为2g。
求:(1)原混合溶液中硝酸银和硝酸铜的物质的量之比。
(2)参加反应的铝的质量。
![]()
![]() 26.(12分)在完全满足可逆反应:2H2O(g) 2H2+O2, 2CO+O2 2CO2
26.(12分)在完全满足可逆反应:2H2O(g) 2H2+O2, 2CO+O2 2CO2
能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
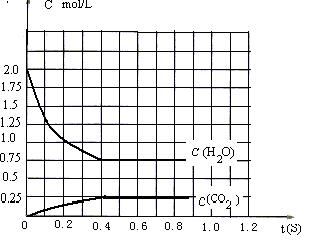
(1)请在图中画出c(H2) 随时间t的变化曲线图;平衡时 c (O2)平为 mol/L。
(2)欲计算出平衡时O2的浓度,除已知“H2O(g)和CO”的物质的量外,至少需要知道平衡体系中某两种气体的平衡浓度。这两种气体除可以是H2O和CO2外还可以是
。
(4)在其它条件不变的情况下,若改为起始时在容器中充入2molH2和2molCO2,则上述两反应达到平衡时,c (O2)平= mol/L。
21.(14分)(1)0刻度以下 (2分)
(2)碱式滴定管、锥形瓶 酚酞 浅红色 无 (5分)
(3)80% (3分)
(4)A、C、E (4分)
22.(1)烧杯、漏斗、玻璃棒(3分)
(2)蒸发浓缩、冷却结晶(2分)
(3) Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O(3分)
(4)途径Ⅱ(1分) 因为滤液A是NaAlO2和NaOH溶液,按途径Ⅰ直接向A中加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ通入CO2气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液(2分)
23.(1)SO3 (4分)
(2) 2Cu2+ +2H2O 2Cu↓ +O2 ↑+4H+ (4分)
(3) 常压,催化剂,400-500oC,并冷却反应后生成的气体 (2分)
24.(1)Fe+2H+ =Fe2+ +H2 ↑ Fe2O3 +6H+ =2Fe3+ +3H2O 2Fe3+ +Fe=3Fe3+ (6分)
(2)1.2 (3分) (3)② NH4+ +NO![]() =N2 ↑+2H2O (4分)
=N2 ↑+2H2O (4分)
![]()
|
解之得:x=0.1 y=0.05 (1分)
x:y=2:1 即硝酸银和硝酸铜的物质的量之比为2:1
 (2)参加反应的铝的质量为W
(2)参加反应的铝的质量为W
根据得失电子数相等可得:x+2(y-![]() )=
)=![]() ×3 (3分)
×3 (3分)
代入x、y,可求得W=1.35(g) (1分)
参加反应的铝的质量为1.35g
26.(10分)(1)如右下图 (2)0.5mol /L (3)H2和CO(或H2和CO2或H2O和CO)
(4)0.5mol/L