高二综合第一学期期末质检
练习
化学试卷(文科)
(考试时间:90分钟;满分:100分)
| 题号 | 一 | 而 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
| 评卷人 |
|
|
|
|
相对原子质量:H-1、N-14、Cl-35.5、Cu-64
第Ι卷(选择题共60分)
一、选择题(本题包括20小题;每小题3分,共60分,每小题只有一个选项符合题意。)
1.关于金属的性质叙述,正确的是( )
A.金属都是银白色的 B.常温下,所有金属都是固体
C.大多数金属有金属光泽,是电和热的良导体 D.金属的熔沸点都很高
2.影响化学反应速率的主要因素是( )
A.参加反应物质的性质 B.催化剂
C.浓度及压强 D.温度
3.下列各组物质属于同位素的是( )
A.35Cl和37Cl B. O2和O3 C.金刚石和C60 D.白磷和红磷
4.下列物质属于纯净物的是
A.碱石灰 B.盐酸 C.铝热剂 D.硝酸银
5.不能使溴水褪色的是
A.CH4 B.NaOH C.CH2==CH2 D.镁粉
6.下列试剂需要避光保存的是:
A.AgNO3 B. Mg C.H2SO4 D.氨水
7.在自然界里,既有以游离态又有以化合态存在的元素是
A.氯 B.氮 C.钠 D.铝
8.下列关于铝的叙述中,不正确的是( )
A.铝属于第ⅢA族元素 B.铝是地壳里含量最多的金属元素
C.在常温下,铝不能与氧气反应 D.铝既能溶于酸溶液,又能溶于强碱溶液
9.下列物质中,属于强电解质,但其水溶液几乎不导电的是( )
A.Ba(NO3)2 B.CH3COOH C.BaSO4 D.Ca(OH)2
10.当可逆反应在一定条件下达到平衡时,正反应速率v正和逆反应速率v逆的关系是( )
A.v正>v逆 B.v正<v逆 C.v正=v逆 =0 D.v正=v逆≠0
11.在2A+B![]() 3C+4D反应中,表示该反应速率最快的数据是
( )
3C+4D反应中,表示该反应速率最快的数据是
( )
A.vA = 0.5mol/(L·s) B.vB = 0.3mol/(L·s)
C.vC = 0.8mol/(L·s) D.vD = 1mol/(L·s)
12.常温下,能盛放在铝制容器里的物质是( )
A.浓HCl B.浓H2SO4 C.稀HNO3 D.CuCl2溶液
13.下列物质的水溶液,其pH大于7的是( )
A.Na2CO3 B.KNO3 C.Na2SO4 D.AlCl3
14.使用铝盐和碱反应制取Al(OH)3,最适当的碱是( )
A.NaOH B.Na2CO3 C.NH3·H2O D.Ca(OH)2
15.某同学在实验报告中有以下实验数据:①用托盘天平称取11.7g食盐,②用量筒量取5.26mL盐酸,③用pH试纸测得溶液的pH是3.5,④用标准NaOH溶液滴定未知浓度的HCl溶液用去23.10mL溶液。其中数据合理的是( )
A.①④ B.②③ C.①③ D.②④
16.在1L1.0mol/L的HNO3溶液中加入1L1.0mol/L的NH3·H2O溶液时,所得到的溶液呈 ( )
A.酸性 B.碱性 C.中性 D.不能确定
17.在强酸性溶液中能大量共存,并且溶液为无色透明的是( )
A.NH4+ Fe2+ SO42- NO3- B.K+ Na+ CH3COO- NO3-
C.K+ Na+ Br- SO42- D.Na+ K+ NO3- HCO3-
18.下列离子方程式书写错误的是( )
A.碳酸钙与盐酸反应:CaCO3 +2 H+=Ca2++H2O+CO2↑
B.铁跟氯化铜溶液反应;Fe + Cu2+ = Fe2+ + Cu
C.氢氧化钡溶液滴入硫酸溶液中:Ba2++SO42—=BaSO4↓
D.醋酸加入氢氧化钠溶液中:CH3COOH+OH—=H2O+CH3COO-
19.下列物质中,其分子式为C5H12的可能是( )
A.2-甲基丙烷 B.2,3-二甲基丁烷 C.2-甲基己烷 D.2,2-二甲基丙烷
20.取两份铝粉,第1份加入足量的盐酸,第2份加入足量的氢氧化钠,如果放出等体积气体,两份铝粉的质量之比为( )
A.1:2 B.1:3 C.3:2 D.1:1
第Ⅱ卷(非选择题共40分)
二、填空题(18分)
21(6分).以下叙述错误的是:
A.随手丢弃废电池会导致土壤污染
B.浓硝酸久置变黄是因为硝酸被空气中的氧气氧化
C.氮族元素是位于周期表中第ⅤA族元素
D.氨气泄露可以用水吸收以消除对环境的污染
E.氮族元素都是非金属元素
F.王水是浓硝酸和浓盐酸(体积比3﹕1)的混合物
G.铜锌原电池中锌是负极
22(3分).在某一化学反应中,反应物B的浓度在5S内从2.0mol/L变成0.5mol/L,在这5S内B的化学反应速率为 。
23(4分).反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)(正反应是放热反应)已达平衡。
CO2(g)+H2(g)(正反应是放热反应)已达平衡。
(1)通入过量的水蒸气,平衡 移动。
(2)减少CO的浓度,平衡 移动。
(3)增大平衡体系的压强,平衡 移动。
(4)使用催化剂,平衡 移动。
24.(5分)A是一种在磁场作用下自身能产生磁性的金属,B、C、D、E、F均含有A元
素,它们之间有如下变化关系:
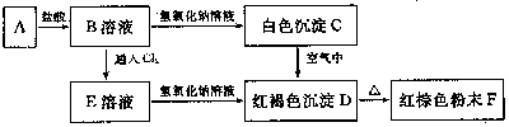
(1) B的名称是__________________________。
(2) F的化学式是_________________________。
(3) C→D反应的化学方程式是:___________________________________________。
三、实验题(15分)
25(10分).有 A、B、C、D、E五种化合物,它们分别由Na+、Ba2+、
![]()
(1)白色固体A既不溶于水,也不溶于稀硝酸。
(2)白色固体B不溶于水,但加入焰色反应为黄色的E溶液时,B溶解且生成无色的溶液。
(3) C与E具有相同的阴离子,C与稀硫酸反应可以生成A。
(4)D是一种棕黄色固体,溶解于水后形成绿色的溶液。D溶液与E溶液反应可以得到蓝色的沉淀。
根据上述实验事实,推断A、B、C、D、E各为什么物质。
A 、B 、C 、D 、E 。
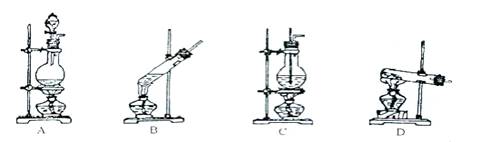
36(5分).实验室制取NH3选择下图所示气体发生装置中的 (填代号),反应的化学方程式: 。收集NH3通常使用 法。
四、综合题(7分)。
37. 9.6g铜溶于足量的稀硝酸。请写出反应的化学方程式,并计算反应产生的气体在标准状况下的体积。
【参考答案】:
一、选择题(本题包括20小题;每小题3分,共60分,每小题只有一个选项符合题意。)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | A | D | A | A | B | D | C | D |
| 题序 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | A | C | A | A | C | C | D | D |
二、填空题(18分)
21(6分).B、E、G
22(3分). 0.3 mol/L·S
23(4分).(1)向右。(2)向左。(3)不。(4)不。
24(5分).(1)氯化亚铁(1分)。(2) Fe2O3(1分)。(3) 4Fe(OH)2+O2+2H2O=4Fe(OH) 3(3分)
三、实验题(15分)
25(10分).
A:BaSO4、B:Al(OH)3、C:Ba(OH)2、D:CuCl2、E:NaOH(每空2分,共10分)
36(5分). D(1分),
2NH4Cl+Ca(OH)2
![]() 2NH3↑+2H2O+CaCl2(3分)
2NH3↑+2H2O+CaCl2(3分)
向下排空法(1分)
四、综合题(7分)。
37.:3Cu + 8HNO3 = 3Cu(NO3)2 ↓+ 2NO↑ + 4H2O(3分)
V(NO) = 9.6g ÷ 64g/mol × ![]() × 22.4L/mol = 2.24L(4分)
× 22.4L/mol = 2.24L(4分)