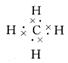高中毕业会考化学试卷3
第Ⅰ卷 (选择题 共50分)
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5 K 39 Fe 56
一、选择题(本题包括20个小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.下列物质中,氯元素的化合价最高的是
A.NaCl B.NaClO C.Cl2 D.KClO3
2.下列各组物质中,互为同位素的是
A.金刚石和石墨 B.氕和氚 C.H2O和D2O D.CH4和C3H8
3.下列物质中,不与水反应的是
A.SiO2 B.CO2 C.Na2O2 D.CaO
4.在下列反应中,HCl既作氧化剂又作还原剂的是
A.NaOH+HCl==NaCl+H2O B.Zn+2HCl==ZnCl2+H2↑
![]() C.2HCl H2↑+ Cl2↑
D.CuO+2HCl==CuCl2+H2O
C.2HCl H2↑+ Cl2↑
D.CuO+2HCl==CuCl2+H2O
5.下列物质中,不能使淀粉碘化钾溶液变蓝的是
A.碘化钠 B.氯水 C.溴水 D.碘水
6.下列有关乙炔性质的叙述中,错误的是
A.能燃烧生成二氧化碳和水 B.能发生加成反应
C.能使高锰酸钾酸性溶液褪色 D.能与氯化氢发生取代反应
7.A、B、C都是金属,把A放入B的盐溶液时,A的表面附着一层B,在由A 与C做电极组成的原电池中,A为原电池的正极。A、B、C三种金属的活动性顺序为
A.A>B>C B.C>A>B C.B>A>C D.B>C>A
8.在相同状况下,等物质的量的铁和铝,分别跟足量的盐酸反应,生成氢气的体积比为
A.1:1 B.1:2 C.2:3 D.3:4
9.下列叙述中,错误的是
A.钠燃烧时发出黄色的火焰 B.钠与硫化合时可以发生爆炸
C.钠是强还原剂 D.钠在空气中燃烧生成氧化钠
10.下列化合物中,只含有离子键的是
A.KOH B.CaCl2 C.H2O D.NH3
11.下列物质中,既能与氢氧化钠溶液反应,又能与盐酸反应的是
A.NH4Cl B.Fe2O3 C.Al(OH)3 D.KNO3
12.下列气体中,不能用排水法收集的是
A.氧气 B.二氧化氮 C.氢气 D.一氧化氮
13.下列试剂中,可用来清洗做过银镜反应实验的试管的是
A.盐酸 B.烧碱溶液 C.蒸馏水 D.硝酸
14.下列溶液中,c(H+)最大的是
A.0.1 mol/L HCl溶液 B.0.1 mol/L NaOH溶液
C.0.1 mol/L H2SO4溶液 D.0.1 mol/L CH3COOH溶液
15.下列关于浓硫酸和稀硫酸的叙述中,正确的是
A.常温时都能用铁制容器盛放 B.加热时都能与铜发生反应
C.都能作为气体的干燥剂 D.硫元素的化合价都是+6价
16.只用一种试剂来鉴别KCl、Ba(NO3)2、NaHCO3三种溶液,这种试剂是
A.稀硫酸 B.稀硝酸 C.稀盐酸 D.氢氧化钠溶液
17.下列物质中,能发生银镜反应的是
A.葡萄糖 B.淀粉 C.蛋白质 D.纤维素
18.下列关于卤族元素的说法中,不正确的是
A.单质的熔点和沸点随着核电荷数的增加逐渐升高
B.单质的颜色随核电荷数的增加逐渐加深
C.单质的氧化性随核电荷数的增加逐渐减弱
D.氢化物的稳定性随核电荷数的增加逐渐增强
19.下列物质中酸性最强的是
A.H3PO4 B.HNO3 C.H2CO3 D.H2SiO3
20.当甲烷与氧气以质量比为1:4混合时,极易发生爆炸。此时甲烷与氧气的体积比为
A.1:4 B.1:2 C.1:1 D.2:1
二、选择题(本题包括5个小题,每小题2分,共10分。每小题有1个或2个选项符合题意,若正确答案只有1个选项,多选时,该题为0分;若正确答案包括2个选项,只选1个且正确给1分,一对一错不给分)
21.下列各组气体,在通常情况下能共存,且都能用浓硫酸干燥的是
A.H2、CO2 B.NO、O2 C.SO2、O2 D.NH3、HCl
22.下列各组离子,能在溶液中大量共存的是
A.K+、H+、SO42—、NO3— B.Na+、H+、OH—、SO42—
C.K+、NH4+、OH—、SO42- D.Fe3+、Na+、Cl—、OH—
23.下列反应达到化学平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2![]() N2O2 (正反应为放热反应)
N2O2 (正反应为放热反应)
B.3O2(g)![]() 2O3 (正反应为吸热反应)
2O3 (正反应为吸热反应)
C.C(s)+CO2(g)![]() 2CO (正反应为吸热反应)
2CO (正反应为吸热反应)
D.N2(g)+3H2(g)![]() 2NH3(s)
(正反应为放热反应)
2NH3(s)
(正反应为放热反应)
24.下列反应的离子方程式,书写正确的是
A.二氧化硫与水反应: SO2+H2O==2H++SO32—
B.碳酸钙与盐酸反应: CaCO3+2H+==Ca2+ +CO2↑+H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH—==Cu(OH)2↓
D.氧化铜与稀硫酸反应: CuO+2H+==Cu2++H2O
25.同周期的X、Y、Z三种元素,已知最高价氧化物的水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断正确的是
A.非金属性:X>Y>Z
B.原子半径:X>Y>Z
C.气态氢化物的稳定性:HX>H2Y>ZH3
D.原子最外层电子数: Z>Y>X
第Ⅱ卷 (非选择题 共50分)
三、填空题(本题包括4小题,共15分)
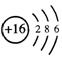
26.(5分)在![]() S原子中含有
个中子, 个电子,它的原子结构示意图为 。在加热的条件下,铁与硫反应生成 ,在这个反应中,硫是 剂(填“氧化”或“还原”)。
S原子中含有
个中子, 个电子,它的原子结构示意图为 。在加热的条件下,铁与硫反应生成 ,在这个反应中,硫是 剂(填“氧化”或“还原”)。
27.(3分)浓硫酸能够用于干燥某些气体,是由于它具有 性;浓硫酸能使纸片变黑,是由于它具有 性;浓硫酸可以与碳反应,是由于它具有 性。
28.(5分)现有5种有机物:① CH2=CH2 ② CH3CHO ③ CH3CH2OH ④ CH3COOH ⑤ CH3COOCH2CH3,请按下列要求填空(填序号)。
(1)能发生银镜反应的是 。(2)能发生消去反应的是 。
(3)能发生水解反应的是 。
(4)具有酸性且能发生酯化反应的是 。
(5)既能发生加成反应,又能发生聚合反应的是 。
29.(2分)50 mL H2SO4的质量分数为35%、密度为1.24g/cm3的硫酸中,H2SO4的物质的量浓度为
mol/L。(计算结果保留1位小数)
四、简答题(本题包括3小题,共15分)
30.(5分)写出下列反应的化学方程式,并按要求填空。
(1)钠和水反应
(2)实验室加热二氧化锰和浓盐酸的混合物制取氯气的反应
(3)苯与浓硝酸和浓硫酸的混合物共热至55℃~60℃发生的反应
反应类型
(4)碳酸氢钠受热分解的反应
31.(2分)写出下列反应的离子方程式。
(1)碳酸钠溶液与足量的稀硫酸反应
(2)氯化铝的水解反应
32.(8分)A、B、C、D都是短周期元素。A元素的原子核外有两个电子层,最外层已达到饱和(8个电子)。B元素与A元素位于同一周期,B元素原子的最外层电子数是A元素原子的最外层电子数的1/2。C元素的离子带有三个单位正电荷,它的核外电子排布与A元素的原子相同。D元素与C元素属同一周期,D元素原子的最外层电子数比A元素原子的最外层电子数少2。
请回答下列问题:
(1)四种元素的名称是:A ,B ,C ,D 。
(2) C元素最高价氧化物对应水化物的化学式是 ,D元素最高价氧化物的化学式是 。
(3)写出B元素的氢化物的电子式: ;其分子呈 结构。
五、实验题(本题包括2小题,共10分)
33.(6分)铜与浓硫酸反应的实验装置如图所示,请回答下列问题。
(1)写出图中有标号仪器的名称:
① ,② 。
(2)铜与浓硫酸反应的化学方程式为: 。
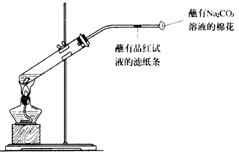 (3)实验过程中,蘸有品红试液的滤纸条会 ,说明二氧化硫具有 性。
(3)实验过程中,蘸有品红试液的滤纸条会 ,说明二氧化硫具有 性。
(4)导管口蘸有Na2CO3溶液的棉花的作用是 。
![]()
![]()
![]()
![]() 34.(4分)已知A、B、B、D分别是AlCl3、BaCl2、NaOH、CuSO4四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
34.(4分)已知A、B、B、D分别是AlCl3、BaCl2、NaOH、CuSO4四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→蓝色沉淀。
③C+D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失。
根据以上事实,推断:
A是 , B是 ,C是 ,D是 。
六、计算题(本题包括2小题,共10分)
35.(4分)在标准状况下,将112 mL HCl气体溶于水,配成50 mL溶液,所得溶液中溶质的物质的量浓度为 mol/L;10 mL该溶液能中和0.2mol/L NaOH溶液的体积为 mL。
36.(6分)某含(NH4)2SO4和NH4NO3的混合溶液200 mL,需消耗100 mL 1mol/L BaCl2溶液才不再产生白色沉淀;又知200 mL此混合溶液在加热条件下与200mL 2mol/L NaOH溶液恰好完全反应。计算200 mL混合溶液中NH4NO3的物质的量浓度。
高中毕业会考化学试卷
参考答案和评分标准
第Ⅰ卷 选择题(共50分)
一、选择题(每小题2分,共40分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | B | A | C | A | D | B | C | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | B | D | C | D | A | A | D | B | B |
二、选择题(每小题2分,共10分)
| 21 | 22 | 23 | 24 | 25 |
| A、C | A | B | B、D | A、C |
第Ⅱ卷 非选择题(共50分)
|
26.16 16 FeS 氧化 (每空1分共5分)
27.吸水 脱水 氧化 (每空1分共3分)
28.② ③ ⑤ ④ ① (每空1分共5分)
29.4.4 (2分)
四、简答题(共15 分)
![]()
![]() 30.(1)2Na + 2H2O 2NaOH + H2↑
(1分)
30.(1)2Na + 2H2O 2NaOH + H2↑
(1分)
|
![]() (3)
取代反应 (每空1分共2分)
(3)
取代反应 (每空1分共2分)
(4)2NaHCO3 Na2CO3 + CO2↑+ H2O (1分)
![]() 31.(1)CO32— + 2H+ CO2↑+ H2O
(1分)
31.(1)CO32— + 2H+ CO2↑+ H2O
(1分)
![]() (2)Al3+ + 3H2O Al(OH)3 + 3H+
(1分)
(2)Al3+ + 3H2O Al(OH)3 + 3H+
(1分)
32.(1)氖 碳 铝 硫 (2)Al(OH)3 SO3
|
(3) 正四面体 (每空1分共8分)
五、实验题(共10分)
![]() 33.(1)酒精灯 铁架台
33.(1)酒精灯 铁架台
(2)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
(3)褪色 漂白
(4)吸收二氧化硫,防止污染 (每空1分共6分)
34.BaCl2 CuSO4 AlC13 NaOH (每空1分共4分)
六、计算题(共10分)
35.0.1 5 (每空2分共4分)
36.解:![]() (NH4)2SO4
+ BaCl2 BaSO4↓ + 2NH4Cl
(NH4)2SO4
+ BaCl2 BaSO4↓ + 2NH4Cl
1 1
n [(NH4)2SO4 ] 0.1 L×1 mol/L
![]()
![]() n [(NH4)2SO4 ] 0.1 mol
(2分)
n [(NH4)2SO4 ] 0.1 mol
(2分)
(NH4)2SO4 + 2NaOH Na2SO4 + 2NH3↑+ 2H2O
1 2
0.1 mol n1(NaOH)
![]() n1(NaOH) 0.2 mol
(1分)
n1(NaOH) 0.2 mol
(1分)
与NH4NO3反应的NaOH的物质的量为:
![]() n2(NaOH) 0.2 L×2 mol/L — n1(NaOH)
n2(NaOH) 0.2 L×2 mol/L — n1(NaOH)
![]()
![]() 0.2 mol
(1分)
0.2 mol
(1分)
NH4NO3 + NaOH NaNO3 + NH3↑+ H2O
1 1
n(NH4NO3) 0.2 mol
![]() n(NH4NO3) 0.2 mol
(1分)
n(NH4NO3) 0.2 mol
(1分)
 |
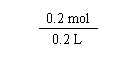
![]()
![]() c(NH4NO3)
c(NH4NO3)
![]() 1 mol/L
(1分)
1 mol/L
(1分)
答:略。