高二上学期第一次月考化学卷
(可能用到的原子量:H-1 O-16 N-14 K-39 Mn-55 Fe-56 S-32)
一、选择题(1-10题每小题2分,11-21题每小题3分,共53分,每小题只有一个正确答案)
1、NO因污染空气而“臭名昭著”,而其奇妙作用也使其成为“明星分子”。如制HNO3肥料、炸药、促进血管扩张、促进免疫功能、增强记忆等。其工业主要来源可能是:( )
A Cu+HNO3→ B N2+O2→ C NH3+O2→ D NO2+H2O→
2、从化学反应速率和化学平衡两方面考虑,合成氨反应采用的条件是( )
A 低温、高压、催化剂 B 低温、低压、催化剂
C 高温、高压、催化剂 D 适当温度、高压、催化剂
3、常温下能溶于浓HNO3的金属是( )
A Au B Al C Cu D Fe
4、在NO2与水反应中,NO2应为( )
A 既是氧化剂,又是还原剂 B 只是氧化剂
C 既不是氧化剂,又不是还原剂 D 只是还原剂
|
![]() 5、在2SO2+O2 2SO3反应中,V2O5的作用是( )
5、在2SO2+O2 2SO3反应中,V2O5的作用是( )
A 只能增大正反应速率 B 提高SO2的产率
C 同时增大正逆反应的速率 D 为了改变反应混合物的组成
6、关于磷的下列叙述中,正确的是( )
A 少量白磷存放于冷水中 B 白磷没有毒性而红磷有剧毒
C 白磷可用于制造安全火柴 D 白磷在空气中加热到260℃可转变为红磷
7、.在密闭容器中放入NO2,在25°C时建立以下平衡
2NO2 (气)![]() N2O4(气) (正反应是放热反应),把此容器置于100°C的沸水中,则下列哪项性质不会改变( )
N2O4(气) (正反应是放热反应),把此容器置于100°C的沸水中,则下列哪项性质不会改变( )
A.颜色 B.平均分子量 C.质量 D.压强
8、检验铵盐的方法是取少量待检物放在试管中,然后( )
A 加热,用湿润的红色石蕊试纸放在试管口观察颜色变化
B 加水溶解,用红色石蕊试纸检验溶液酸碱性
C 加入NaOH浓溶液,加热,用湿润的红色石蕊试纸放在试管口观察颜色变化
D 加入强碱溶液,加热,再滴入酚酞试液
9、某集气瓶呈红棕色,加入足量水,盖上玻璃片,振荡,得橙色溶液,气体颜色褪减,再打开玻璃片后,瓶中气体又变为红棕色。该气体可能是下列混合气中的( )
A N2、NO2、Br2 B NO2、NO、N2
C NO2、O2、NO D N2、O2、Br2
![]() 10、某温度下,反应ClF(g)+F2(g) ClF3(g)
(正反应为放热反应),在密闭容器中达平衡,则下列说法正确的是( )
10、某温度下,反应ClF(g)+F2(g) ClF3(g)
(正反应为放热反应),在密闭容器中达平衡,则下列说法正确的是( )
A 温度不变,缩小体积,ClF的转化率增大
B 温度不变,增大体积,ClF3的产率提高
C 升高温度,增大体积,有利于平衡向正反应方向移动
D 降低温度,体积不变,F2的转化率降低
11、下列各组离子在水溶液中能大量共存的是( )
A CO32-、H+、HCO3-、Ca2+ B NH4+、OH-、Ba2+、NO3-
C I-、ClO-、NO3-、H+ D SO32-、SO42-、Na+、OH-
12、锌与某浓度的HNO3完全反应,消耗的锌与HNO3的物质的量之比为5︰12,则还原产物中氮元素的价态可能是( )
 A +4 B +2 C +1 D 0
A +4 B +2 C +1 D 0
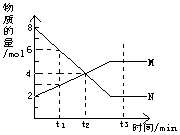
13、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是:( )
A 反应的化学方程式为:2M![]() N
N
B t2时,正逆反应速率相等,达到平衡
C t3时,正反应速率大于逆反应速率
D t1时,N的浓度是M浓度的2倍
14、已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
① 生成物的质量分数一定增加;②生成物产量一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用催化剂
A ①②③ B ③④⑤ C ②⑤ D ④⑥
15、在体积为VL的密闭容器中,通入a mLNO、bmLO2反应后容器中氮原子数和氧原子数之比为( )
A B C D
![]() 16、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O Fe(OH)2+2H+,往该溶液逐滴加入盐酸,发生的变化是
16、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O Fe(OH)2+2H+,往该溶液逐滴加入盐酸,发生的变化是
(已知3Fe2++4H++NO3-=3Fe3++NO↑+2H2O)
A、平衡不移动 B、平衡向正方向移动
C、溶液颜色由浅绿色变为棕黄色
D、溶液颜色由浅绿色变为深绿色
17、一充满氨气的烧瓶作喷泉实验,当水充满整个烧瓶后,烧瓶内氨水的物质的量浓度是(标准状况下)( )
A 0.0045 mol·L-1 B 1 mol·L-1
C 0.0029 mol·L-1 D 0.045mol·L-1
|
|

|
|
|
C T1>T2,P1>P2 D T1>T2,P1<P2
19、0.3molCu2S与足量的浓硝酸反应,生成硝酸铜、硫酸、二氧化氮和水,则参加反应的硝酸中,未被还原的硝酸的物质的量为( )
A 0.6mol B 1.2 mol C 2.2 mol D 3.0 mol
![]() 20、已知反应AOn-+B2-+H+ AO2+B+H2O,浓度为0.3mol·L-1的AOn-溶液100mL恰好与900mL 0.05mol·L-1的B2-溶液完全反应,则n值是( )
20、已知反应AOn-+B2-+H+ AO2+B+H2O,浓度为0.3mol·L-1的AOn-溶液100mL恰好与900mL 0.05mol·L-1的B2-溶液完全反应,则n值是( )
A 1 B 2 C 3 D 4
21、下列事实中不能应用勒沙特列原理来解释的是:( )
A 往硫化氢水溶液中加碱有利于S2-的增加
B 加入催化剂有利于氨氧化的反应
C 500℃左右比室温更有利于合成氨的反应
D 高压有利于合成氨的反应
三、填空题(47分)
 22、(13分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图。其中A、B、C、常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
22、(13分)右图表示A、B、C、D、E五种含氮物质相互转化的关系图。其中A、B、C、常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
(1)各物质的化学式为:
A、 B、
C、 D、 E、
(2)各步反应的化学方程式为:
A→C: D→C:
B→E: E→C:
![]() 23、(10分)在密闭容器中盛有HI气体,在400℃时建立如下平衡:2HI H2+I2(正反应为吸热反应),改变下列条件,请填空:(填写变化情况)
23、(10分)在密闭容器中盛有HI气体,在400℃时建立如下平衡:2HI H2+I2(正反应为吸热反应),改变下列条件,请填空:(填写变化情况)
⑴将温度升至480℃,混合气体的颜色 ,HI的分解率 ,化学平衡向 移动,平衡常数 ,混合气体的总质量 ;
![]() ⑵若将密闭容器的体积压缩了 ,则混合气体的颜色 ,HI的分解率 ,化学平衡向 移动,平衡常数 ,混合气体的总质量 。
⑵若将密闭容器的体积压缩了 ,则混合气体的颜色 ,HI的分解率 ,化学平衡向 移动,平衡常数 ,混合气体的总质量 。
![]() 24、(4分)反应2A B+C,在某一温度时,达到平衡。
24、(4分)反应2A B+C,在某一温度时,达到平衡。
⑴若温度升高,A的转化率变小,则正反应是 热反应;
⑵若B是固体,降低压强时,平衡向左衔移动,则A是 态物质;
⑶若A是气态物质,加压时,平衡不移动,则B为 态,C为 态。
![]() 25、(6分)有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度:c(A)=2mol·L-1,c(B)=3mol·L-1,c(C)、 c(D)均为0。反应开始2s钟后达到平衡状态,此时D的平衡浓度为0.15 mol·L-1,则从起始到达平衡时间内的平均反应速率c(C) 为 ,A的转化率为 ,B的平衡浓度 。
25、(6分)有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度:c(A)=2mol·L-1,c(B)=3mol·L-1,c(C)、 c(D)均为0。反应开始2s钟后达到平衡状态,此时D的平衡浓度为0.15 mol·L-1,则从起始到达平衡时间内的平均反应速率c(C) 为 ,A的转化率为 ,B的平衡浓度 。
|
|
|
|
|
|
|
此反应中1mol水还原Cl2物质的量为 mol。
⑵(6分)将VmLNO和NO2的混合气体通过水吸收后,得到amL无色气体A,将此无色气体A与等体积的O2混合,再通过水充分吸收后,收集到5mL无色气体B。
①A气体是 ,B气体是 ;
②A气体的体积是 mL;
③V的取值范围是 。
![]()
|
百分含量随温度变化如右图,则
⑴T0对应的υ正与υ逆的关系是 ;
⑵A、B两点正反应速率大小关系是 ;
|
|
四、计算题(共8分)
28、(4分)在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求平衡混合物中N2和H2的体积分数各为多少?
29、(4分)某合成氨厂,日生产能力为30吨,现以日产NH3为原料生产NH4NO3,若硝酸车间的原料转化率为92%,氨被吸收为NH4NO3的吸收率为98%,则硝酸车间日生产能力应生产多少吨硝酸才合理?