高二上学期化学期中考试A
原子量:S 32 O16 H1 Cl 35.5 N 14 Cu 64 K 39 Na23 C 12
一、选择题(共20分,每小题只有一个选项符合题意)
1. 下列物质中氮气素的化合价为-3价的是
A.N2O B.NH2Cl C.N2O4 D.KNO3
2.氨水存在的粒子有
①NH3 ②H2O ③NH3·H2O ④NH4+
⑤OH![]() ⑥H+
⑥H+
A.只有①② B.只有②③ C.只有②④⑤ D.六种都有
3.能证明非金属性氮化磷强的事实是
A.硝酸比磷酸的酸性强 B.通常氮气为气态而磷为固态
C.NH3极易溶于水而PH3难溶于水 D.PH3比NH3稳定
4.NO2通入水中可以制是硝酸,在此反应中NO2的作用
A.只作氧化剂 B.既作氧化剂,又作还原剂
C.只作还原剂 D.既不作氧化剂,又不作还原剂
5.关于硝酸的下列说法中,正确的是
A.硝酸具有不稳定性和强氧化性 B.硝酸与活泼的金属反应,一般生成氢气
C.硝酸的酸酐是NO2 D.常温下,农硝酸使Zn钝化
6.下列气体在常温下能大量共存的是
A.NO、O2 B.H2S、SO2 C.NH3、HCl D.N2、O2
7.下列离子能大量共存的是
A.H+、Na+、OH-、Cl![]() B.NH4+、NO3
B.NH4+、NO3![]() 、SO4
、SO4![]() 、OH
、OH![]()
C.H+、Na+、NO3![]() 、SO4
、SO4![]() D.H+、Na+、NO3
D.H+、Na+、NO3![]() 、S
、S![]()
8.增大压强时,下列反应速率不会变大的是:
A.碘蒸气和氢气化合生成碘化氢 B.稀硫酸和氢氧化钠溶液反应
C.二氧化碳通入澄清石灰水 D.氨的催化氧化
9.盐酸与Na2CO3反应时,能使反应的最初速率明显加快的是
A.增加Na2CO3粉末的量 B.盐酸的量增加一倍
C.盐酸浓度减半用量加倍 D.温度升高40℃
10.对某一可逆反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率 B.同样程度改变正逆反应的速率
C.增大正反应速率,减小逆反应速率 D.改变平衡混合物的组成
二、选择题(共32分,每小题有1—2个选项符合题意)
11.氮族元素与同周期的VIA族、VIA族元素相比,关系正确的
A.原子半径小 B.原子半径大 C.非金属性弱 D.非金属性强
12.下列离子方程式书写正确的是
A.FeCI3溶液与Fe粉反应Fe3++Fe=2Fe2+
B.硫酸铵溶液加入适量的氢氧化钡溶液Ba2++SO4![]() 2-=BaSO4↓
2-=BaSO4↓
C.氯化镁溶液与氨水混合Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+
D.碳酸铵溶液与稀盐酸反应CO3![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
13.已知NO2与Br2的氧化能力相当,鉴别NO2与Br2蒸气,不能采用的方法是
A.分别溶于水,观察水溶液的颜色
B.分别加入CCl4振荡,观察液体的颜色
C.用湿润的淀粉KI试纸检验,观察试纸的颜色
D.分别加入少量的AgNO3溶液,振荡后观察有无沉淀
14.体积相同的三个烧瓶,分别盛满HCl、NH3、NO2气体,将其分别倒扣在水糟中,充分溶解后塞住瓶口从水槽取出,烧瓶内三种溶液的物质的量的浓度之比为(设瓶内的溶质不扩散)
A.1:1:1 B.3:3:2 C.2:2:3 D.2:3:3
15.已知4NH3+5O2 ![]() 4NO+6H2O,若反应速率分别用VNH3、VO2、VNO、VH2O(mol·min)表示,则正确的关系是
4NO+6H2O,若反应速率分别用VNH3、VO2、VNO、VH2O(mol·min)表示,则正确的关系是
A.4/5VNH3=VO2 B.5/6VO2=VH2O
C.2/3VNH3=VH2O D.4/5VO2=VHO
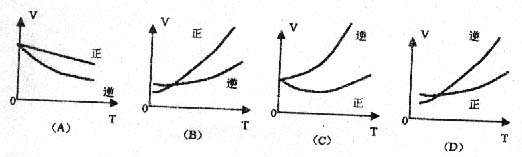
16.对于平衡状态的反应,A+B![]() AB正反应为吸热反应,温度对反应的速率的影响,正确的是
AB正反应为吸热反应,温度对反应的速率的影响,正确的是
17.溴水中存在着下列平衡:Br2+H2O![]() HBr+HBrO,要使溴水褪色,可加入的试剂是
HBr+HBrO,要使溴水褪色,可加入的试剂是
A.AgNO3溶液 B.稀硫酸 C.NaOH溶液 D.NaBr溶液
18.对于可逆反应N2+3H2 ![]() 2NH3(正反应为放热反应)下列说法正确的是
2NH3(正反应为放热反应)下列说法正确的是
A.达到平衡时反应物和生成物浓度一定相等
B.达到平衡后入氮气,当重新达到平衡时,氨的浓度比原平衡时增大,氢气浓度比原平衡时减少
C.达到平衡时,升高温度,加快了吸热反应速率,降低了放热反应速率,所以平衡向逆反应方向移动
D.加入催化剂可以缩短达到平衡所用的时间,这是因为加快了正反应速率,而减慢了逆反应速率
19.在2SO2+O2 ![]() 2SO3可逆反应中,为了提高SO2的利用率,要采用的方法是:
2SO3可逆反应中,为了提高SO2的利用率,要采用的方法是:
A.增大压强 B.使用催化剂
C.增加氧气的浓度 D.增大SO2的浓度
20.某温度下,反应N2O4(气)![]() 2NO2(气)(正反应为吸热反应),在密闭容器中达到平衡,下列说法不正确的是
2NO2(气)(正反应为吸热反应),在密闭容器中达到平衡,下列说法不正确的是
A.体积变小时,将使正反应速率增大
B.体积保持不变,加入少许NO2,将使正反应速率减少
C.体积保持不变,加入少许N2O4,再达到平衡颜色变深
D.体积保持不变,升高温度,再达到平衡颜色变深
21.在一化学平衡mA(气)+nB(气)![]() pC(气)+qD(气);A的转化率(aA%)同压强(Pa)、温度(T)的关系如图,分析图可以得出的正确结论是
pC(气)+qD(气);A的转化率(aA%)同压强(Pa)、温度(T)的关系如图,分析图可以得出的正确结论是
A.
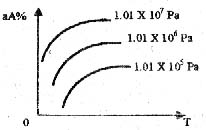 正反应是吸热反应m+n>p+q
正反应是吸热反应m+n>p+q
B. 正反应是吸热反应m+n<p+q
C. 正反应是放热反应m+n>p+q
D.正反应是放热反应m+n<p+q
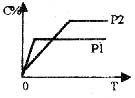 22.在温度相同,压强分别为P1、P2条件下,A(气)+2B(气)
22.在温度相同,压强分别为P1、P2条件下,A(气)+2B(气)![]() nC(气)的反应体系中,C的体系分数(C%)随时间(t)变化的曲线如图,下列结论正确的是
nC(气)的反应体系中,C的体系分数(C%)随时间(t)变化的曲线如图,下列结论正确的是
A.P1> P2 n<3 B.P1< P2 n>3
C.P1< P2 n=3 D.P1> P2 n>3
23.某温度下,反应A+B![]() 2C在密闭容器中进行,当反应达到平衡时,下列叙述正确的
2C在密闭容器中进行,当反应达到平衡时,下列叙述正确的
A.当升高温度时,平衡逆向移动,说明正反应是放热的
B.升高温度时可以增大正,逆反应速率,对平衡移动没有影响
C.若增加或减少B物质的量时对化学平衡无影响,则B所处状态气态
D.若A为气态,而加压平衡不移动,则B一定是气态,C也是气态。
24.把选项中的四种x溶液,分别加进四个盛有10mL 2mol/L盐酸的烧怀中,并且均加水稀释至50Ml,此时,x和盐酸缓缓的进行反应,其中反应速度最快的是
A.10Ml 2mol/L B.20mL 2mol/L C.10ML4mol/L D.20ML3mol/L
25.一定条件下,将等体积的NO2和O2的混合气体充满试管,并将试管倒立于水槽中,充分反应后,剩余气体的体积为原体积的
A.1/4 B.3/4 C.1/8 D.3/8
26.在标准状况下,将O2与NO按3:4体积比充满一个烧瓶,将烧瓶倒立水中,充分反应后,液体上升充满烧瓶,最后瓶内溶液的物质的量的浓度为(假设瓶内的溶质不扩散)
A.0.045mol/L B.0.036mol/L C.0.03mol/L D.0.02mol/l
三、填空题
27.(8分)写出氮族元素的名称和符号 、 、 、 、 。氮气分子的电子式为 。氨分子的电子式为 氨分子是由 健构成的 分子。
雷雨天雨水中常含微量的硝酸,它进入土壤后,能与土壤中的矿物质作用,生成可被植物吸收的硝酸盐,促进植物的生长,请写出形成硝酸的三个有关化学方程式 、
、 。
28.(3分)浓硝酸有时呈黄色,这是由于 缘故,有关的化学方程式为 ,所以实验室中应用 瓶保存浓硝酸。
![]() 29.(4分)配平① S+ KOH K2S+ K2SO3+ H2O
29.(4分)配平① S+ KOH K2S+ K2SO3+ H2O
![]() ② MnO4
② MnO4![]() + H++ Cl
+ H++ Cl![]() Mn2++ Cl2↑+ H2O
Mn2++ Cl2↑+ H2O
30.(5分)实验室制氨气的原理是(用化学方程式表示) ,
收集时应用 法。检验氨气是否收集满所用的试剂为 。制氨气的装置还可以制备哪种常见的气体 。
31.(2分)除NO中的NO2应使用 (试剂)。
除去NaCl固体中的NH4Cl固体,其操作方法为 。
32.(2)分检验某白色固体中是否含有NH4+,其操作方法和步骤为
。
33.(3分)铜和足量的浓硝酸反应,如果有32gCu参加反应,则转移的电子数为 mol参加还原的硝酸为 mol,被还原的元素为 。
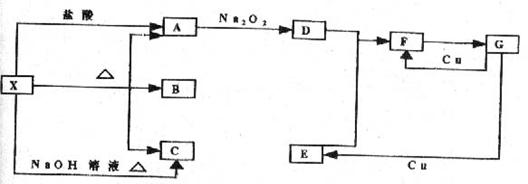 34.(4分)图中A、B、C、D、E、F、G分别表示为反应物或生成物,其中A、C为无色气体,D是使带火星的木条复燃的无色气体。
34.(4分)图中A、B、C、D、E、F、G分别表示为反应物或生成物,其中A、C为无色气体,D是使带火星的木条复燃的无色气体。
试推断:A 、C 、F 、G 。
35、(5分)在2L的密闭容器中,200℃放入6molA气体和4molB气体,已知MA=30g/mol,MB=32g/mol,发生2A(气)+B(气)![]() C(气),3s后反应 达到平衡,这时测得C气体为2.6mol
C(气),3s后反应 达到平衡,这时测得C气体为2.6mol
①达到平衡时,A的转化率为 。
②此反应以A的浓度变化表示的化学反应速率为 mol/L·s,以B的浓度变化表示的化学反应速率为 mol/L·s
③平衡后,A的物质的量的浓度为 mol/L。
④平衡后,混合气体的平均分子量为 。
四、计算题(共12分)
36.有1.6g某硫公物样品,在氧气中灼热使其完全转化为SO2,然后将SO2氧化为SO3。再用水吸收转化为硫酸,所得的硫酸可用40ml lmol/L的NaOH完全中和。计算原硫化物样品中含硫的质量分数。(8分)
37.白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙三份质量不同的A样品分别与50.0ml相同浓度的盐酸充分反应得到气体的体积(标准状况)与A的质量关系如下表
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸的体积/mL | 50.0 | 50.0 | 50.0 |
| A样品的质量/g | 2.84 | 5.25 | 7.00 |
| 气体的体积/L | 0.672 | 0.896 | 0.896 |
试计算:1.盐酸的物质的量的浓度(2分)
2.混合物中NaHCO3的质量分数(2分)
上学期高二化学期中考试答案
一、选择题(每小题2分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| D | B | C | C | C | C | D | D | C |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | C | C | A | B | B | A | B | D |
二、选择题(每小题3分,多选、选错不给分,少选一个给2分)
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| BD | BD | AC | BD | D | CD | AC | A |
三、填空题(28题3分,31题4分,其余每空1分)
27.CH4;天然气、沼气;无水醋酸钠和碱石灰;
|
CH3COONa+NaOH——→CH4↑+Na2CO3
|
28.CH4+2O2——→CO2+2H2O;点燃少量气体,在其上方罩一干燥的烧杯,烧杯内壁有水雾产生,证明有水生成;倒转烧杯,注入少量澄清石灰水,振荡,石灰水变浑浊,证明有二氧化碳生成。
29.HCl;NO;CO2
30.1:1
31.KAl(SO4)2·12H2O;Al3++3OH-====Al(OH)3↓
Al(OH)3+OH-====AlO2-+2H2O SO42-+Ba2+====BaSO4↓
32.(0.1+a)mol
|
33.(1)碱石灰;(2)2NH4Cl+Ca(OH)2=====CaCl2+2NH3↑+2H2O
(3)打开止水夹,将滴管内的水挤入烧瓶中
(4)长导管内有水喷出,喷出的溶液为红色
(5)氨气极易溶于水,氨气的水溶液呈碱性
(6)A C
34.(1)白色沉淀变为灰绿色,最终为红褐色
4Fe(OH)2+2H2O+O2====4Fe(OH)3; 2Fe3++Fe====3Fe2+
(2)FeCl3 Fe(NO3)3 (3)B
五、计算题(35题4分,36题6分)
35.N(Bacl2)=0.2mol/L×0.05L=0.01mol
Bacl2+H2SO4=BaSO4↓+2HCl
1mol lmol 2.33g
0.01mol n(H2SO4) m(BaSO4)……………………11分
n(H2SO4)=0.01mol C(H2SO4)=![]() =0.1mol/L (2分)
=0.1mol/L (2分)
m(BaSO4)=2.33g (1分)
36.(1)0.52<n<0.70mol (2分) (2)0.24mol/L (2分) (3)(3.00-2a-3b)mol/L(2分)