高二上学期期末化学试卷3
可能用到的相对原子质量:C 12 H 1 O 16 N 14 S 32
Na 23 Mg 24 Al 27 Cu 64
一、选择题(每小题3分,共54分。在每小题给出的四个选项中,只有一个选项是正确的。)
1、除去铁表面的铜镀层,可以选用的试剂是( )
A.稀硝酸 B.浓硝酸 C.稀硫酸 D.浓硫酸
2.不能使酸性KMnO4溶液褪色的是 ( )
A.乙烯 B.聚乙烯 C.甲苯 D.乙炔
3、下列几种情况对中和滴定结果无影响的是
A 盛待测液的锥形瓶用待测液润洗过。
B 滴定管尖嘴部分在滴定前有气泡
C 在滴定前未将滴定管刻度调在0,而调在2.40
D 滴定达到终点时,视线高于滴定管内液体的凹面的最低点
4.25℃时某溶液中由水电离出的c(OH-)为1×10-11mol/L,则该溶液的PH可能等于( )
①11 ②8 ③7 ④3
A.①④ B.①② C.①③ D.②③、
5.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为 ( )
A.1010:1 B.5×109:1 C.108:1 D.1:1
6、向一种强酸HA溶液中加入一种碱MOH,反应后溶液呈中性,下列判断一定正确的是
A 加入的碱过量 B 生成的盐不水解
C 酸与碱等物质的量混合 D 反应溶液中c(A-)=c(M+)
7、下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入催化剂
A.全部 B.①②⑤ C.② D.②③
![]() 8.合成氨反应N2+3H2 2NH3正反应为放热反应,为增加氨 气产量,工厂应采取的正确措施是:
8.合成氨反应N2+3H2 2NH3正反应为放热反应,为增加氨 气产量,工厂应采取的正确措施是:
A.高温、高压 B.适宜温度、高压、催化剂
C.高温、低压 D.低温、高压、催化剂
9、某无色透明溶液中,放入铝片,立刻有大量H2产生,则下列离子在该 溶液中可以大量存在的是……(
)
A、OH-、NO3-、Ba2+、Cl- B、H+、Ba2+、Mg2+、NO3-
C、H+、Cu2+、Al3+、SO42- D、Na+、K+、MnO4-、Cl-
10、某无色溶液中加入过量的HCl有沉淀生成,过滤后向滤液中加入过量的纯碱溶液又有沉淀生成,下列溶液中符合此条件的是:①Ag+、Fe3+、Na+ ②Ag+、Al3+、K+ ③Ag+、Ba2+、NO3-⑧ ④SiO32-、AlO2-、K+ ⑤Ag+、NH4+、H+ ⑥SiO32-、K+、Al3+
A、①②③④ B、②③④ C、②③④⑥ D、①②③④⑥
11、下列物质的水溶液能在蒸发皿中加热浓缩到原物质的是……( )
①NaAlO2 ②FeCl3 ③明矾 ④绿矾 ⑤KNO3 ⑥H2S ⑦HCl ⑧Na2SO3 ⑨CaCl2
A、①③⑤⑥⑨ B、②③④⑤⑧⑨
C、③⑤⑦⑨ D、①③⑤⑨
![]() 12 在密闭容器中发生反应2SO2(气)+O2
(气) 2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
12 在密闭容器中发生反应2SO2(气)+O2
(气) 2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
A.10mol和10% B.20mol和20%
C.20mol和40% D.30mol和80%
13、38.4mg Cu与适量的浓HNO3 反应,铜全部作用后,共收集到22.4mL气体(标准状态下),反应消耗的HNO3的物质的量可能为( )
A.1.0×10-3 mol B1.6×10-3 mol
C.2.2×10-3 mol D2.4×10-3 mol
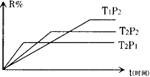
![]() 14、在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L此反应符合下列图象(R%为R在平衡混合物中的体积分数),则该反应是(
)
14、在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L此反应符合下列图象(R%为R在平衡混合物中的体积分数),则该反应是(
)
|
B.正反应是放热反应,L是气体
C.正反应是吸热反应,L是固体
D.正反应是放热反应,L是固体或液体
15.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中错误的是:
A.由Al、Cu、稀硫酸组成的原电池,其正极反应式为:2H++2e-= H2↑
B.由Al、Mg、NaOH溶液组成的原电池,其负极反应式为:Mg-2e- = Mg2+
C.由Fe、Cu、FeCl3 溶液组成的原电池,其正极反应式为:Fe3++e- = Fe2+
D.由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e- = Cu2+
16.在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与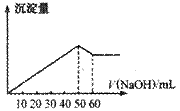 MgSO4的物质的量浓度之比为:
MgSO4的物质的量浓度之比为:
A.6∶1 B.3∶1
C.2∶1 D.1∶2
。
17.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:
HC≡C—C≡C-C≡C-C≡C-C≡N。对该物质判断正确的是( )
A.不能使溴的四氯化碳溶液褪色
B.B.能使酸性高锰酸钾溶液褪色
C.不能发生加成反应
D.可由乙炔和含氮化合物加聚制得
18.甲烷和乙炔的混合气体20 mL,完全燃烧需45 mL氧气(同温同压下),则此混合气体中甲烷和乙炔的体积比是 A.1∶1 B.2∶1 C.3∶1 D.4∶1
第Ⅱ卷(非选择题,共44分)
二、填空题(共20分)
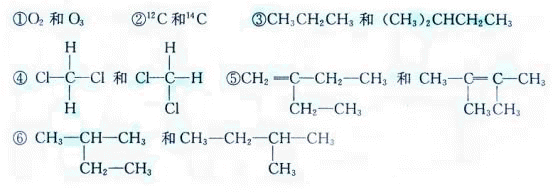
19(6分)下列各组物质互为同系物的是_____(填编号,下同)互为同分异构体的是____,互为同位素的是____,互为同素异形体的是_____,属于同一种物质的是_____。
20(13分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是___________________、_____________________、__________________________________。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是_______________________________________。
(5) 和 两种粒子的物质的量之和比OH-多0.008mol
三、实验题共(19分)
21、(5分)以试管和胶头滴管为仪器,用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备白色的Fe(OH)2沉淀。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。②生成白色Fe(OH)2沉淀的操作是
, 这样做的理由是 。
22、(14)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量电石与水反应,将生成的气体通入溴水中,发现溶液褪色即证明乙炔与溴水生发了加成反应。乙同学发现在甲同学的实验中,褪色后溶液里有少许淡黄色的浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要原化学方程式
(2)甲同学设计的实验 (填能或不能)验证乙炔与溴发生加成反应,其理由是 。
a、使溴水褪色的反应,未必是加成反应
b、使溴水褪色的反应,就是加成反应
c、使溴水褪色的物质,未必是乙炔
d、使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有一种杂质气体是 它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)实现乙同学的实验方案,将它们编号填入方框,并在括号中写出装置内所放的化学药品。
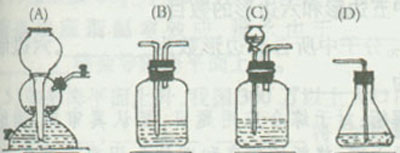
![]()
![]() (电石、水) ( )
( ) (溴水)
(电石、水) ( )
( ) (溴水)
(5)为验证这一反应是加成而不是取代,丙同学提出可pH试纸来测试反应后溶液的酸性,理由是
四、计算题(8分)
23、某一定量的苯的同系物完全燃烧,生成的气体依次通过浓硫酸和氢氧化钠溶液,经测定前者增重10.8克,后者增重39.6克(均完全吸收)。又知该苯的同系物苯环上的一氯代物、二氯代物、三氯代物都只有一种。求该苯的同系物的分子式并写出结构简式。