高二同步练习原电池原理及其应用(1)
1.关于铜、锌和稀H2SO4构成的原电池的说法正确的是
A.锌是正极,铜是负极 B.H+在溶液里移向铜片
C.电流由锌流向铜 D.电子经外电路由锌流向铜
2.铁钉和炭棒用导线连接后,浸入到0.01mol·L-1 NaCl溶液中,可能发生的是
A.炭棒上有H2析出 B.炭棒附近产生OH- C.炭棒上有O2析出 D.铁钉被氧化
3.下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是
A.Cu、Ag、AgNO3溶液 B.Zn、Cu稀H2SO4 C.Fe、Zn、CuSO4溶液 D.Fe、C、Fe2(SO4)3溶液
4.实验中欲制得H2,最好的方法是
A.纯锌与稀H2SO4 B.纯锌和浓H2SO4 C.纯锌与稀盐酸 D.粗锌(含铜杂质)与稀H2SO4
5.钢铁在潮湿的空气中发生电化腐蚀时,正极发生的主要反应是
A.Fe-2e=Fe2+ B.2H2O+O2+4e=4OH- C.4OH--4e=2H2O+O2 D.2H++2e=H2↑
6.埋在地下的铸铁输油管道,在下列各种情况下,腐蚀最慢的是
A.在含铁元素较多的酸性土壤中 B.在潮湿疏松透气的土壤中
C.在干燥致密不透气的土壤中 D.在含碳粒较多的潮湿透气中性土壤中.
7.铜铁在锈蚀过程中,下列五种变化可能发生的是
①Fe由+2价转化为+3价 ②氧气被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3 .nH2O ⑤杂质碳被氧化而除去. A.①② B.③④ C.①②③④ D.①②③④⑤
8.有a,b,c,d四种金属,将a,b用导线连结起来,浸入电解质溶液中,b不易腐蚀;将a,d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸入b的盐溶液中,无明显变化;将铜浸入c的盐溶液里,有金属c析出.据此推知它们的活动性由强到弱的顺序为
A.dcab B.dabc C.dbac D.badc
9.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池的容量更大,而且没有污染,其总反应式为:2Zn+O2![]() 2ZnO
所用原料为锌粒、电解液和空气.则下列叙述中,正确的是
2ZnO
所用原料为锌粒、电解液和空气.则下列叙述中,正确的是
A.锌为正极,空气进入负极反应 B.负极反应为 Zn - 2e ![]() Zn 2+
Zn 2+
C.正极发生氧化反应 D.电解液肯定不是强酸
10.燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解液为强碱溶液. 下列关于甲烷燃料电池的说法中,正确的是
A.负极反应为:CH4+10OH--8e=![]() +7H2O
B.负极反应为:O2+2H2O+4e
+7H2O
B.负极反应为:O2+2H2O+4e![]() 4OH-
4OH-
C.随着放电进行,溶液中的阴离子向负极移动 D.随着放电进行,溶液的PH不变.
11.常用的钮扣电池为银锌电池,它分别以锌和氧化银为电极.放电时锌极上的电极反应是:Zn+2OH--2e![]() Zn(OH)2,氧化银极上的反应是:Ag2O+H2O+2e
Zn(OH)2,氧化银极上的反应是:Ag2O+H2O+2e![]() 2Ag+2OH-,下列判断中,正确的是 A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
2Ag+2OH-,下列判断中,正确的是 A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是负极,发生还原反应,氧化银是正极,发生氧化反应
D.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
12.以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生锈 D.银质奖牌久置后表面变暗
13.图4—9装置能够组成原电池的是
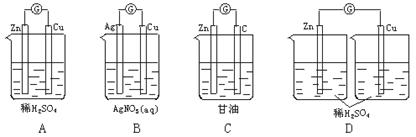
14.所示,组成一种原电池.试回答下列问题(灯泡功率合适):
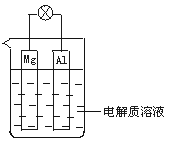 (1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”).若灯泡亮,则Mg电极上发生的反应为:_______________ Al电极上发生的反应为:_______________ 若灯泡不亮,其理由为:_________________________________
(1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”).若灯泡亮,则Mg电极上发生的反应为:_______________ Al电极上发生的反应为:_______________ 若灯泡不亮,其理由为:_________________________________
(2)电解质溶液为NaOH(aq)时,灯泡__________(填“亮”或“不亮”).若灯泡亮,则Mg电极上发生的反应为:_______________ Al电极上发生的反应为:_______________ 若灯泡不亮,其理由为:_____________________
15.如何利用Cu+2FeCl3=2FeCl2+CuCl2设计一个原电池,画出装置图,写出电极的反应式.
原电池原理及其应用(2)
1.铅蓄电池的两极分别为Pb、PbO2,电解液为H2SO4,工作时的反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O, 下列结论正确的是A.Pb为正极被氧化 B.PbO2为负极被还原
C.![]() 只向PbO2处移动 D.电解液密度不断减小
E.溶液的PH不断减小
只向PbO2处移动 D.电解液密度不断减小
E.溶液的PH不断减小
2.锌锰干电池的正极是石墨炭棒,它放电时的总反应可表示为:Zn(固)+2MnO2+2NH+4![]() Zn2++Mn2O3(固)+2NH3+H2O,在电池放电时,正极表面发生反应的物质是 A.Zn B.石墨 C.MnO2和NH+4 D.Zn2+和NH3
Zn2++Mn2O3(固)+2NH3+H2O,在电池放电时,正极表面发生反应的物质是 A.Zn B.石墨 C.MnO2和NH+4 D.Zn2+和NH3
3.锂电池是一种新型高能电池,它以轻质、高能而受到普遍重视,目前已研制成功了多种锂电池.某种锂电池的总反应可表示为:Li+MnO2=LiMnO2,若该电池提供0.5C电量(1mol电子的电量为96500C),则消耗正极材料的质量(其它损失不计)约为
A.3.63×105g B.3.5g C.4.51×10-4g D.43.5g
4.纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量 A.CuSO4溶液 B.CuS固体 C.铜 D.镁条
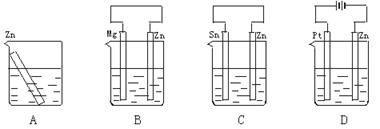 5.分别放置在图4—10所示装置(都盛有0.1
mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是
5.分别放置在图4—10所示装置(都盛有0.1
mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是
6.已知空气—锌电池的电极反应为:
锌片:Zn+2OH--2e-===ZnO+H2O; 碳棒:1/2 O2+H2O+2e-===2OH-
据此判断,锌片是 A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
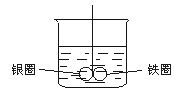 7.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.片刻后可观察到的现象是(指悬吊的金属圈)_______.
7.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.片刻后可观察到的现象是(指悬吊的金属圈)_______.
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
8.镍—镉(Ni—Cd)可充电电池可以发生如下反应:
![]()
由此可知,该电池的负极材料是A.Cd B.NiO(OH) C.Cd(OH)2 D.Ni(OH)2
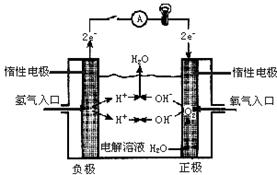 9.如图所示,可形成氢氧燃料电池.通常氢氧燃料电池有酸式(当电解质溶液为H2SO4时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种.试回答下列问题:氢氧燃料电池示意图如右:
9.如图所示,可形成氢氧燃料电池.通常氢氧燃料电池有酸式(当电解质溶液为H2SO4时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种.试回答下列问题:氢氧燃料电池示意图如右:
(1) 酸式电池的电极反应:负极__________
正极________________
电池总反应:_______________ 电解质溶液pH的变化__________
(2) 碱式电池的电极反应:负极__________
正极________________ 电池总反应____________________________ 电解质溶液pH的变化__________
10.我国首创的以铝—空气—海水电池为能源的新型海水标志灯已研制成功.这种灯以取之不尽的海水为电解质溶液,靠空气中的氧使铝不断氧化而源源产生电流.只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.试推测此种新型电池可能的基本结构及电极反应式:
(1)__________是负极,电极反应式为___________________________.
(2)__________是正极,电极反应式为___________________________.
11.氯铝电池是一种新型的燃料电池,电解质溶液是KOH(aq).试回答下列问题:
(1)通入Cl2(g)的电极是__________极(填“正”或“负”).
(2)通入Al(g)的电极是__________极(填“正”或“负”).
(3)电子从__________(填“Al”或“Cl2”,下同)极流向__________极.
(2)产生上述现象的原因是________________________.
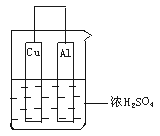 12.如右图 ,由浓H2SO4、Cu、Al组成一个原电池,已知Cu、Al过量.试写出可能的电极反应式,并指出正、负极及电极反应类型.
12.如右图 ,由浓H2SO4、Cu、Al组成一个原电池,已知Cu、Al过量.试写出可能的电极反应式,并指出正、负极及电极反应类型.
(1) Al片:_________________________
____________________ (可不填满,也可补充,下同);
(2)Cu片:______________________________
______________________________