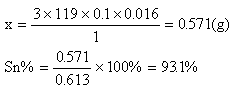期终考试
期终考试
高二年级(理班)第一学期化学科试卷 命题人 韩文斌
(全卷满分:100分,考试时间:90分钟)
相对原子质量:H:1 C:12 O:16 Mg:24 Al:27 Fe:56 Zn:65 Cu:64 Sn:119
![]() 第Ⅰ卷(选择题部分50分)
第Ⅰ卷(选择题部分50分)
一、 选择题(单选,第1—10小题各2分,第11—20小题各3分)
将选择题答案序号填在Ⅱ卷的答案栏内,否则,不与记分。
1.下列物质中,不能跟镁反应的是( )
A、氩气 B、氮气 C、稀硝酸 D、二氧化碳
2.现代建筑门框架,常用电解加工成古铜色的硬铝制造。硬铝是( )
A、Al-Mg合金 B、 Al-Cu-Mg-Mn-Si合金
C、表面有氧化膜的纯铝 D、表面没有氧化膜的纯铝
3.下列溶液中,不需要避光保存的是
A.硝酸银溶液 B.浓盐酸 C.浓硝酸 D.氯水
![]() 4.物质的量相同的下列溶液等体积混合后,溶液的pH大于7的是
4.物质的量相同的下列溶液等体积混合后,溶液的pH大于7的是
A. NaHCO3 HCl NaCl B. K2CO3 H2SO4 HCl
C. Na2CO3 CH3COONa HNO3 D. NaOH NaNO3 HCl
5. 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确次序
A. c(Na+)> c(Cl-)> c(OH-)> c(H+) B. c(Na+)= c(Cl-)> c(OH-)> c(H+)
C. c(Na+)= c(Cl-)> c(H+)> c(OH-) D. c(Cl-)>c(Na+)> c(OH-)> c(H+)
6.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g)![]() 4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则反应方程式中的n值为
4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则反应方程式中的n值为
A.2 B.3 C.4 D.5
7.将1摩CO和1摩H2O混合在一定条件下反应: CO+H2O(气)
![]() CO2+H2, 达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的 ( )
CO2+H2, 达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的 ( )
![]() (A) 5.75倍 (B) 11.5倍 (C) 23倍 (D) 30.67倍
(A) 5.75倍 (B) 11.5倍 (C) 23倍 (D) 30.67倍
8.在较高的温度下,有反应2HBr![]() H2+Br2(气)一热,要使混合气体颜色加深又不改变HBr的分解率,可能达到目的的方法是
H2+Br2(气)一热,要使混合气体颜色加深又不改变HBr的分解率,可能达到目的的方法是
(A)增大体积 (B)升高温度 (C)缩小体积 (D)同时加入一定量的HBr和Br2
装9.称取两份铝粉,第一份加足量的浓NaOH溶液,第二份加足量盐酸,如要放出等体积的气体(同温同压),两份铝粉的质量之比为
A.1:2 B.1:3 C.3:2 D.1:1
10.钢铁表面吸附了中性水膜发生电化腐蚀.这时①铁作正极被氧化,②铁作负极被氧化, ③水膜中有气体析出.④空气中某成分气体被还原.其中正确的是
A.①③ B.②④ C.②③ D.①④
11.下面的电离方程式正确的是
A.H2S![]() 2H++S2- B.HF
2H++S2- B.HF![]() H++F-
H++F-
C.Na2HPO4![]() 2Na++H++PO43- D.H2CO3
2Na++H++PO43- D.H2CO3![]() H++HCO3-
H++HCO3-
12.物质的量浓度相等的下列溶液PH由大到小的顺序是
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.Na2CO3、NaCl、NH4Cl、NaHCO3
D.Na2CO3、NH4Cl、NaHCO3、NaCl
13.将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是
A.KCl B.Mg(OH)2 C.Na2CO3 D.MgSO4
14.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
A.在氧化还原反应中,1个甲原子失去的电子比1个乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是正极
15.能与Fe3+反应,且能证明Fe3+具有氧化性的试剂是
①SCN- ②Fe ③Fe2+ ④Cu ⑤H2S ⑥OH-
A.①②③ B.②④⑤ C.①③⑥ D.①②⑤
16.某无色透明溶液能与铝作用放出氢气。此溶液中可能大量共存的离子组是
A.NH4+、NO3-、CO32-、Na+ B.Na+、Ba2+、Mg2+、HCO3-
C.NO3-、Mg2+、K+、Cl- D.NO3-、K+、OH-、AlO2-
17.下列事实不能用勒夏特列原理解释的是
A.CaCO3不溶于水,但溶于盐酸
B.约有85%的化学反应需要使用催化剂
C.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫
D.氯气难溶于饱和食盐水
18.用0.1mol/LNaOH溶液滴定0.1mol/L HCl,若达到滴定终点时不慎多加了一滴NaOH溶液(一滴溶液的体积约为0.05ml),继续加水至50ml,所得溶液的pH为
A. 4 B. 7.2 C. 10 D. 11.3
19.已知某可逆反应在密闭容器中进行反应:A(g)+ 2B(g)![]() 3C(g)+D(g)
3C(g)+D(g)
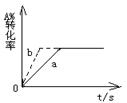 (正反应为放热反应),如图示,a代表一定条件下该反应的情况。
(正反应为放热反应),如图示,a代表一定条件下该反应的情况。
若使a曲线变为b曲线,可采取的措施是
A.增大A的浓度 B.加入催化剂
C.缩小容器的体积 D.升高温度
20. 两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2 L气体,则这种混合物可能是
A.Zn、Al B.Fe、Zn
C.Al、Mg D.Mg、Cu
第一学期期终考试
高二年级(理班)化学科试卷 命题人 韩文斌
(全卷满分:100分,考试时间:90分钟)
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 | ||||||
| 评卷人 |
选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案序号 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案序号 |
二、填空、(15分)
21、(7分)在25°C时,纯水中C(H+)·C(OH-)=_________________;
在NH4Cl溶液中C(H+)_____10-7mol/L(大于、小于或等于)pH_____7(大于、小于或等于);
在Na2CO3溶液中C(H+)_____10-7mol/L (大于、小于或等于) pH_____7(大于、小于或等于)
在NaCl溶液中C(H+)_____10-7mol/L (大于、小于或等于) pH_____7(大于、小于或等于);
22、(8分)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其
电极反应式为:Zn+2OH—=ZnO+H2O+2e— Ag2O+H2O+2e—=2Ag+2OH—
电池的负极是______________,正极发生的是_______________反应(反应类型),
总反应式为______________________________________________________________
电池放电时,氧化剂是: (填化学式)氧化产物 (化学式)
三、 推断题(10分)
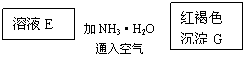
23、(10分)某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
| |||
![]()
![]()
![]()
 | |||||||
 | |||||||
|
|
|
|
|
|

(1)单质F是_____________
(2)写出由E生成G的离子反应方程式__________________________________________
(3)溶液M中所含金属离子是_____________
![]() (4)由C E+F的反应中,稀酸I能否改用浓硝酸,为什么?
(4)由C E+F的反应中,稀酸I能否改用浓硝酸,为什么?
___________________________________________________________________________
___________________________________________________________________________
四、 实验题(18分)
24、(共8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+
===2Mn2+ + 5SO42- + 3H2O 填空回答问题:
(1)该滴定实验所需仪器有下列中的______________________________(填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台
F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。若滴定后(终点)平视液面刻度为c mL,假设被滴定的未知浓度NaHSO3溶液的体积为V mL,请写出求NaHSO3溶液的物质的量浓度的计算式:___________________________________________________________
25、(10分)下图是一套实验室制气装置,用于发生、干燥和收集气体.在NO2、Cl2、SO2、H2S、H2、NO等气体中.该装置可制取、干燥和收集的气体是 .
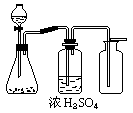
若用上述装置制取该气体,你认为该套装置有何缺点?有何建议?
。
五、 计算题(7分)
26、(7分)1mol/L AlCl3溶液75mL与2mol/LNaOH溶液120mL混合,可得到Al(OH)3沉淀多少克?
选做题:
金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为: ![]() 再加入过量的FeCl3溶液,发生如下反应:
再加入过量的FeCl3溶液,发生如下反应:
![]()
最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为:
![]()
现有金属锡试样0.613g,经上述反应后,共用去0.100mol/L K2Cr2O7溶液16.0ml,试求试样中锡的质量分数(假定杂质不参加反应)。
第一学期期终考试
高二年级(理班)化学科试卷
理班试卷参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案序号 | A | B | B | C | B | A | B | C | D | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案序号 | D | A | C | C | B | D | B | C | B | A |
21、1X10-14、>、<、<、>、=、= (各1分共7分)
22、Zn(2分)、还原(2分)、Zn+Ag2O=ZnO+2Ag(2分)Ag2O;ZnO(2分)
23、(1)H2 (2分)
(2)4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3 ↓+8NH4+ (4分)
或Fe2+ +2 NH3·H2O=Fe(OH)2↓+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al3+和Na+ (2分)
(4)不能,因为铁在浓硝酸中会发生钝化 (2分)
24. (1) ABDEFGH (2) 少; 小 (3 ) C(NaHSO3)=2.5 x 0.001(c-a)/V moL(每空2分)
25.SO2、NO2 、Cl2(6分) 因所制气体均有毒害作用,从环保角度看,装置缺少尾气处理装置;建议增加尾气处理装置,或其他合理建议。(4分)
26、(7分)
n= 4n Al3+ — n OH-=4x1X0.075-2x0.012=0.06mol
m=0.06x78=4.68g
选做题:
解:3Sn![]() 3SnCl2
3SnCl2![]() 6FeCl2
6FeCl2![]() K2Cr2O7
K2Cr2O7
3Sn![]() K2Cr2O7
K2Cr2O7
3×119 1
x 0.1×0.016