高二年级第一次阶段考试化学试卷(选修类)
可能用到的相对原子质量:C—12 H—1 O—16 Fe—56 Au—197
Ⅰ卷( 56 分 )
一、单项选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项)
1、关于氢键,下列说法正确的是 ( )
A、每一个水分子内含有两个氢键
B、冰、水和水蒸气中都存在氢键
C、水的熔点比H2S高
D、由于氢键作用,H2O是一种非常稳定的化合物
2、下列各组物质中,都是由极性键构成为极性分子的一组的 ( )
A、CH4 和 H2O B、CO2 和 HCl
C、NH3 和 H2S D、HCN 和 BF3
3、既有离子键又有共价键和配位键的化合物是 ( )
A、NH4NO3 B、NaOH C、H2SO4 D、H2O
4、下列说法中错误的是 ( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A、 ①②③④ B、只有②③ C、只有③④ D、只有①②③
5、根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是 ( )
 |
A、SiCl4是分子晶体
B、MgCl2中键的强度比NaCl中键的强度小
C、单质R是原子晶体
D、AlCl3为离子晶体
6、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 ( )
A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B、沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C、向反应后的溶液加入乙醇,溶液没有发生变化
D、在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
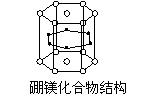 7、2001年报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。右图示意的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为
( )
7、2001年报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录。右图示意的是该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为
( )
A、MgB B、Mg3B2 C、Mg2B D、Mg2B3
8、.已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出 氢气。下列叙述正确的是 ( )
A、LiH的水溶液显中性 B、LiH中的氢离子可以被还原成氢气
C、LiH是一种强氧化剂 D、LiH中氢离子比锂离子的离子半径大
二、不定项选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9、最简式相同, 但既不是同系物, 又不是同分异构体的是 ( )
A、辛烯和3—甲基—1—丁烯 B、苯和乙炔
C、1—氯丙烷和2—氯丙烷 D、甲基环己烷和乙烯
10、下列物质的类别与所含官能团不都正确的是 ( )
![]()
![]() A、
酚类 -OH B、
羧酸 -COOH
A、
酚类 -OH B、
羧酸 -COOH
C、 醛类 –CHO D、CH3-O-CH3 醚类
11、NA代表阿伏加德罗常数值,下列说法正确的是 ( )
A、9g重水所含有的电子数为5NA
B、1molMgCl2中含有离子数为NA
C、7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D、1molC10H22分子中共价键总数为31NA
12、当S03晶体熔化或气化时,下述各项中发生变化的是 ( )
A、分子内化学键 B、分子间距离 C、分子构型 D、分子间作用力
13、某溶液中加入金属铝有氢气放出,则在此溶液中可能大量共存的离子是( )
A、K+、Mg2+、NO3—、SO42— B、K+、Na+、Cl—、HCO3—
C、K+、Na+、AlO2—、SO42— D、K+、NH4+、Cl—、CO32—
14、下列物质的熔、沸点高低顺序正确的是 ( )
A、金刚石,晶体硅,二氧化硅,碳化硅 B、CI4>CBr4>CCl4>CH4
C、MgO>H20>02>N2 D、金刚石>生铁>纯铁>钠
15、组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中能代表晶体结构特征的最小重复单位称为晶胞。在冰晶石(Na3AlF6)晶胞中,AlF63-占据的位置相当于NaCl晶胞中C1-占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的离子数之比为 ( )
A、2:1 B、3:2 C、5:2 D、5:1
 16、如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是
( )
16、如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是
( )
A、键角为120℃
B、化学组成为SiO32-
C、键角为109°28′
D、化学组成为SiO44-
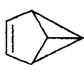 17、盆烯是近年合成的一种有机物,它的分子结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是
( )
17、盆烯是近年合成的一种有机物,它的分子结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是
( )
A、盆烯是苯的一种同分异构体
B、盆烯分子中所有的碳原子不可能在同一平面上
C、盆烯是乙烯的一种同系物
D、盆烯在一定条件下可以发生加成反应
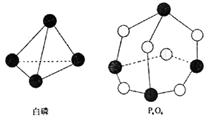 18、化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如右
18、化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如右
图所示,现提供以下化学键的键能(kJ·mol-1)
P—P:198 P—O:360 O=O:498,
则反应P4(白磷)+ 3O2 → P4O6的反应热△H为(化
学反应的△H等于反应中断裂旧化学键的键能之和
与反应中形成新化学键的键能之和的差)( )
A、-1638 kJ/mol B、+1638 kJ/mol
C、-126 kJ/mol D、+126 kJ/mol
Ⅱ卷(64分)
三、填空题
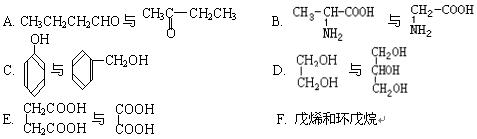
19、(12分)(1)下列各化合物中,属于同系物的是(填入编号) ,属于同分异构体的是 。
(2) 按系统命名法命名
① 有机物CH3CH(C2H5)CH(CH3)2的名称是________________________.
② 在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”。C7H16的同分异构体中具有“手性碳原子”的有_______种,名称分别为___________________________________________________________________________
20、(8分)下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表形成共价键的最外层电子,短线代表价键,如,F2:![]() 。以下四种图式各代表的分子是:
。以下四种图式各代表的分子是:
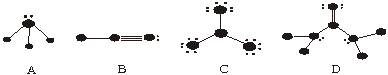
A ,B ,C ,D 。
21、(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、
E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________,乙物质的电子式是____________。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是_____ _(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是_____
__。
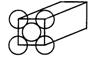 22、(4分)金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,求
22、(4分)金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,求
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2)金的密度为_________g·cm-3。
23、(12分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是:
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
(3)在一定条件下,甲与O2反应的化学方程式是:
(4)丁的元素符号是 ,它的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似。
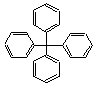 24、(6分)(1)甲烷分子中的4个氢原子全部被苯基取代,可得如图
24、(6分)(1)甲烷分子中的4个氢原子全部被苯基取代,可得如图
所示的分子, 该分子中共平面的C原子最多有 个,
共平面的原子最多有 个。
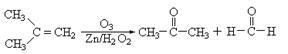 (2)在有机化学分析中,根据反应的性质和反应产物,即可确定烯烃的组成和结构(双键及支链的位置),例如:
(2)在有机化学分析中,根据反应的性质和反应产物,即可确定烯烃的组成和结构(双键及支链的位置),例如:
据以上线索和下列反应事实,确定C7H14的结构和名称:
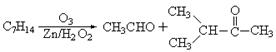 该烃的结构简式是_________________
该烃的结构简式是_________________
四、计算题
25、(6分)某气态烃含C 85.7%,含H 14.3%,在标准状况下的密度是2.5g/L。该烃能使酸性高锰酸钾溶液或溴水褪色。求该烃的分子式,并写出它的各种同分异构体的结构简式。
26、(8分)将0.2mol 金属R的一种含氧酸盐在隔绝空气的条件下加热,使之完全分解,生成R的氧化物RO和CO、CO2的混合气体。已知:该混合气体对氢气的相对密度为18,其体积为8.96L(标准状况);金属R的原子核中质子数比中子数少4。测得RO的质量比原含氧酸盐质量减轻一半。通过计算,求出该盐的化学式。