高二年级第一学期教学质量检测化学试题卷
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的相对原子质量:Cu 64 Fe 56 Al 27 O 16 Ca 40 C 12
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.利用新技术能将不锈钢加工成为柔软的金属丝,它和棉纤维一起编织成为性能优良的劳防服装,这是利用了金属的
A.耐腐蚀性 B.还原性 C.热传导性 D.延展性
2.据某媒体报道:德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图。从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高。其原因是这些地区的
A.硝酸工业发达 B.雷雨天气较多
C.机动车辆过多 D.燃料以煤为主
3.已知一些金属单质的发现与其活泼性存在着某种必然联系。你认为下列事件发生在铁器时代之前的是
A.金属铝的冶炼 B.金、银的使用
C.戴维发现金属钠 D.15世纪中国使用锌铸币。
4.下列说法不正确的是
A.凡是铵盐均能与苛性钠共热产生氨气
B.碳酸氢铵受热分解产生的气体以碱石灰干燥后可得到纯净的氨气
C.氨气溶于水后,水溶液中主要以铵离子形式存在
D.若无催化剂的作用,氨的氧化产物一般为氮气
5.下列对硝酸的认识不正确的是
A.打开浓硝酸的瓶盖会产生棕色的烟
B.稀硝酸也是一种强氧化性的酸
C.硝酸是常用来作制炸药、化肥、染料的化工原料
D.不慎将浓硝酸滴在手上,擦去后仍会在皮肤上留下黄色斑痕
6.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪色;③将镁粉放入液溴中.未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只能直接与溴水中的溴反应
B.水是镁粉与溴发生反应的催化剂
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉与溴水中的酸发生反应,导致平衡移动使溴水褪色
7.白磷的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P—P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是
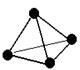 A.化合物A的分子式为P2O3
A.化合物A的分子式为P2O3
B.化合物A是磷酸的酸酐
C.化合物A是最高价氧化物
D.化合物A中每个原子最外层都达到8电子的稳定结构
8.对已达化学平衡的下列反应:2X(g)+Y(g)![]() 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
9.下列哪种方法不能增大铁跟盐酸反应的速率
A.用粉末状铁代替块状铁
B.用1mol∙L-1HCl代替0.1mol∙L-1HCl
C.增大压强
D.改用不纯的铁代替纯铁
10.常温时,将Vl mL cl mol∙L-1的氨水滴加到V2 mL c2 mol∙L-1的盐酸中,下叙结论中正确的是
A.若混合液的pH=7,则clVl =c2V2
B.若混合液的pH=7,Vl =V2,则cl>c2
C.若Vl=V2,cl=c2,则混合液中c(NH4+)=c(Cl-)
D.若Vl=V2,且混合液的pH<7,则一定有cl<c2
11.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生Cu2S+2Cu2O![]() 6Cu+SO2↑,关于该反应的下列说法中,正确的是
6Cu+SO2↑,关于该反应的下列说法中,正确的是
A.该反应的氧化剂中只有Cu2O
B.Cu既是氧化产物,又是还原产物
C.氧化产物与还原产物的物质的量之比为6 :1
D.Cu2S在反应中既是氧化剂,又是还原剂
12.以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录如下表:
| 待测液 | 消耗标准盐酸(0.10 mol∙L-1)的体积 | |
| ① | 20mLNaOH溶液 | V1 mL |
| ② | 20mLNaOH溶液+1mL蒸馏水 | V2mL |
| ③ | 21mLNaOH溶液 | V3mL |
该新制的NaOH溶液的浓度c合理的是
A.c== mol·L-1 B.c== mol·L-1
C.c== mol·L-l D.c== mol·L-1
13.在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中肯定不含有Fe3+
B.残余固体肯定不含有铁
C.最后得到的溶液中肯定不含有Cu2+
D.残余固体中肯定不含有铜
14.用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe ![]() H2
H2![]() Cu,②CuO
Cu,②CuO![]() CuSO4
CuSO4 ![]() Cu。
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是
A.相等 B.①多 C.②多 D.无法判断
15.有一未完成的离子方程式为![]() ,若X为主族元素,据此判断:X元素的最高化合价为
,若X为主族元素,据此判断:X元素的最高化合价为
A.+1 B.+4 C.+5 D.+7
16.有人认为NO2可以称为混合酸酐。下列化学方程式所代表的反应中你认为能正确描述NO2是混合酸酐的化学方程式是
①2NO2+2NaOH==NaNO3+NaNO2+H2O
②2NO2+H2O==HNO2+HNO3 3HNO2==HNO3+2NO↑+H2O
③NO2+NO+2NaOH==2NaNO2+H2O
A.①②③ B.②③ C.①③ D.①②
17.现有碳酸钠、氢氧化钡和硫酸三种体积和物质的量浓度都相等的溶液,几位同学按不同顺序将它们混合(产生的沉淀立即过滤掉),对于最后所得溶液,下列说法正确的是
A.一定显碱性 B.不可能显碱性
C.不可能显中性 D.不可能显酸性
18.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 。下列推断正确的是
A.Tl+的最外层有1个电子 B.Tl3+的氧化性比Al3+弱
C.Tl 能形成+3价和+1价的化合物 D.Tl+的还原性比Ag强
19.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
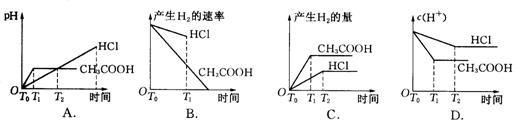
20.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是
二、简答题(本大题共5小题,共30分)
21.(7分)写出下列化学方程式或离子方程式:
(1)点燃的镁条伸入盛满二氧化碳的集气瓶中(化学方程式) ▲ _;
(2)灼热的铁与水蒸汽(化学方程式) ▲ _;
(3)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 ▲ 性(填“酸性”、“碱性”或“中性”),其原因是(用离子方程式表示) ▲ _;
22.(4分)某些化学试剂可用于净水,水处理中使用的一种无机高分子混凝剂的化学式可表示为〔Al2(OH)nClm·yH2O〕x,式中m与n的关系式: ▲ _;若让1 mol混凝剂转化为 Al(OH)3,要结合OHˉ的物质的量为 ▲ _mol。
|
![]() 23.(6分)高炉炼铁中Fe2O3+3CO
2Fe+3CO2的反应是一个可逆反应。在19世纪后期,人们发现高炉炼铁所排出的高炉气中含有相当数量的CO,造成原料的浪费,于是工程师们耗费了大量资金增加了高炉的高度,他们为什么设想这样做可提高CO的利用率? ▲ 。后来发现尽管高炉的高度增加了许多,但炉气中CO的量并未有明显减少,这是什么原因?
▲
。
23.(6分)高炉炼铁中Fe2O3+3CO
2Fe+3CO2的反应是一个可逆反应。在19世纪后期,人们发现高炉炼铁所排出的高炉气中含有相当数量的CO,造成原料的浪费,于是工程师们耗费了大量资金增加了高炉的高度,他们为什么设想这样做可提高CO的利用率? ▲ 。后来发现尽管高炉的高度增加了许多,但炉气中CO的量并未有明显减少,这是什么原因?
▲
。
从这一事情给我们哲学上的启示是什么? ▲ 。
24.(6分)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 ▲ 。
(2)该反应中,发生还原反应的过程是 ▲ → ▲ 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
▲ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 ▲ L。
25(7分).已知NO2和N2O4可以相互转化:2NO2![]() N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温刚性密闭容器中,各物质的浓度随时间变化关系如下图所示。根据如图所示,回答下列问题:
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温刚性密闭容器中,各物质的浓度随时间变化关系如下图所示。根据如图所示,回答下列问题:
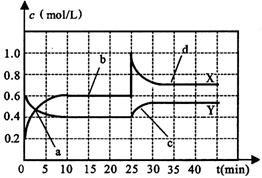
(1)图中共有两条曲线X和Y,其中曲线 ▲ 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 ▲ 。
(2)前10min内用NO2表示的化学反应速率v(NO2)= ▲ mol∙L-1∙min-1;反应进行至25min时,曲线发生变化的原因是 ▲ 。
(3)若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是 ▲ 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
三、实验题(本大题共3小题,共18分)
26.(6分)某化学兴趣小组通过如下实验由表面沾有油污的废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 ▲ ,加热能明显提高效果的原因是 ▲ 。
(2)实验步骤②明显不合理,理由是 ▲ 。
(3)实验步骤④中用少量冰水洗涤晶体,用冰水其目的是 ▲ 。
(4)要检验制得的硫酸亚铁晶体是否变质,操作方法是 ▲ 。
 27.(6分)氨跟氧化铜反应可以制取氮气,而氮气跟镁在高温下可得氮化镁, 氮化镁与水反应生成氢氧化镁和氨气。
27.(6分)氨跟氧化铜反应可以制取氮气,而氮气跟镁在高温下可得氮化镁, 氮化镁与水反应生成氢氧化镁和氨气。
右图装置A、装置B都可用作实验室制氨气,
(1)若选取A装置,则制氨的化学方程式 ▲ _;
(2)选取B装置,则可用 ▲ _和 ▲ _两种常用药品来制取。
(3)以下流程图是某同学提出的制氮化镁的一种实验方案图 (实验前系统内空气已排除)
B中产生的气体 →碱石灰→浓硫酸 →CuO粉末(灼热)→镁粉(高温)→(以下从略)
该方案未能制得氮化镁,你认为其原因是 ▲ _;
请你仿照上述形式,在以下流程图中设计一个实验方案(方框内不一定填满)制氮化镁
B中产生的气体 → ▲ _;→ ▲ _;→ ▲ _;→ ▲ _;→(以下从略)
28.(6分)以下是高中化学教材第二册中的一个学生实验,请填写实验报告中的相关内容。
| 实验步骤 | 实验现象 | 解释和结论 |
| (1)在一个50mL烧杯中放入两块铝片,再加入适量浓硝酸,使铝片浸没在酸液中,观察现象。稍待片刻,用镊子取出铝片,用水洗净表面的酸液。 (2)将用浓硝酸处理过的铝片放入盛有CuSO4溶液的烧杯中,浸泡片刻,观察现象。 (3)然后取出其中一片铝片,用小刀在其表面刻划几下(或用砂纸将其表面打磨干净 ),再放入CuSO4溶液中,观察发生的现象并加以解释。 | (1) ▲ (2) ▲ (3) ▲ |
(4)本实验可得出的结论: ▲ 。 |
四、计算题(本大题共2小题,共12分)
29.(6分)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
⑴ 若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为bL。反应的化学方程式是___________▲____________
样品中铝的质量是_____▲_______g。
⑵ 若取ag样品将其点燃,恰好完全反应,该反应的化学方程式是:__________▲__________,氧化铁和铝的质量比是______▲_______。
⑶ 待⑵中反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与⑴中所得气体的体积比c:b=_________▲_______
30.(6分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5g(相当于钙元素600mg),成人每天服用1片。”
(1)“1.5g碳酸钙与600mg的钙”的计量关系是如何得出来的,请列式表示。
(2)该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1L溶液,取其20mL,然后用0.01mol∙L-1KMnO4 溶液滴定,反应中用去6mLKMnO4溶液,发生的离子反应为:
2MnO4― +5H2C2O4
+6H+
![]() 2Mn2+
+10CO2↑+8H2O
2Mn2+
+10CO2↑+8H2O
①请通过计算回答该片剂中碳酸钙的含量。
②你认为该片剂的名称应该叫“钙尔奇D____▲____片剂”。