高二年级
 第一学期期中考试化学试卷
第一学期期中考试化学试卷
(时间90分钟,满分100分)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
![]() 可能用到的相对原子质量: H-1 C-12 N-14 O-16 K-39 S-32 Cu-64
可能用到的相对原子质量: H-1 C-12 N-14 O-16 K-39 S-32 Cu-64
一、选择题(下列各题只有一个选项符合题意。本题共22题,每题2分,共44分)
1. 在氮族元素中,下列原子半径最大是 ……………………………………( )
A.氮 B.磷 C.砷 D.锑
2. 下列说法正确的是 ………………………………………………………( )
A.酸性:H3PO4>HNO3
B.气态氢化物稳定性:PH3<NH3
C.第VA族元素都是非金属元素
D.氮比磷难与氢化合生成气态氢化物
3. 镁在空气中燃烧,下列说法正确的是………………………………………( )
A.只有氧化镁生成
B.只有氮化镁生成
C.氧化镁、氮化镁均有,但氮化镁较多
D.氧化镁、氮化镁均有,但氧化镁较多
4. 下列不属于氮气用途的是 …………………………………………………( )
A.氮气在常温下很稳定
B.用于粮食及食品的保鲜、贮存
C.作为铝制品、铝型材等金属焊接时的保护气
D.液化后用来保存待移植的活性器官,在冷冻麻醉条件下开刀
5. 下列电子式表示正确的是 …………………………………………………( )
A. N2的电子式 ![]() B.N2的电子式
B.N2的电子式 ![]()
![]()
![]() C.NH3的电子式 D.NH3的电子式
C.NH3的电子式 D.NH3的电子式
6. 下列反应式,能正确表示氨水电离过程的是 ……………………………( ) A.NH3•H2O![]() NH4++OH-
B.NH3•H2O→ NH4++OH-
NH4++OH-
B.NH3•H2O→ NH4++OH-
C.NH4OH![]() NH4++OH-
D.NH4OH→ NH4++OH-
NH4++OH-
D.NH4OH→ NH4++OH-
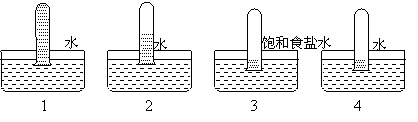 |
7. 四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满NH3的试管是………………( )
A.1 B.2 C.3 D.4
8. 人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒,下列叙述正确的是( )
A.维生素C是氧化剂 B.维生素将Fe3+还原成Fe2+
C.亚硝酸盐被氧化 D.亚硝酸盐是还原剂
9. 下列氮的氧化物中,称为硝酸酸酐的是…………………………………………( )
A.NO B.N2O3 C.NO2 D.N2O5
10. 某气体具有下列性质:①红棕色气体②水溶液呈酸性③加入AgNO3溶液无沉淀。该气体是 ………………………………………………………………………………( )
A.溴蒸气 B.NO C.NO2 D.Cl2
11. 加热下列物质,试管口没有红棕色气体出现的是……………………………( )
A.硝酸钾固体 B.硝酸铜固体
C.浓硝酸 D.铜跟稀硝酸的混合物
12. 二氧化氮存在下列平衡:2NO2(g) ![]() N2O4(g)+Q ,为准确测定NO2的相对分子质量,下列条件较为适宜的是 ……………………………………………………( )
N2O4(g)+Q ,为准确测定NO2的相对分子质量,下列条件较为适宜的是 ……………………………………………………( )
A.升温减压 B.降温增压
C.升温增压 D.降温减压
13. 用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是……………………………………………………………………………………( )
A.测定密度 B.观察外观
C.放入盐酸中 D.放入浓硝酸中
14. 硝酸在反应中既表现酸性,又表现氧化性的是……………………………( )
A.Cu与HNO3反应 B.H2S与HNO3反应
C.CuO与HNO3反应 D.Mg(OH)2与HNO3反应
15. 有关硝酸化学性质的叙述,正确的是………………………………………( )
A.浓硝酸具有热稳定性
B.稀硝酸能与Fe反应生成H2
C.浓硝酸可与Cu反应生成NO2
D.常温下浓、稀硝酸均能使铁、铝钝化
16. 要鉴别浓H2SO4和浓HNO3两种溶液,不能选用的试剂是…………………( )
A.BaCl2溶液 B.蔗糖
C.铜片 D.Al2O3粉末
17. 若将铁片投入下列溶液中,能产生大量H2的是………………………………( )
A.稀HNO3 B.浓HNO3 C.稀H2SO4 D.浓H2SO4
18. 将下列固体置于隔绝空气的密闭容器中加热,在加热过程中发生化学反应,但冷却一段时间后又能生成原来物质的是 ………………………………………………( )
A.铁片 B.NH4Cl C.碘片 D.H2O
19. 在强碱性溶液中, 下列离子不能大量存在的是 ……………………………( )
A.K+ B.Na+ C.Ba2+ D.NH4+
20. 有关铵盐性质的叙述,正确的是………………………………………………( )
A.都是晶体,难溶于水 B.受热均难以分解
C.与碱共热时可以产生氨气 D.都能与酸反应
21.下列有关叙述,不正确的是………………………………………………………( )
A.二氧化氮溶于水能形成无色溶液
B.一氧化氮可用向上排空气法收集
C.浓硝酸在潮湿的空气中能形成白雾
 D.氯气能使湿润的碘化钾淀粉试纸变蓝
D.氯气能使湿润的碘化钾淀粉试纸变蓝
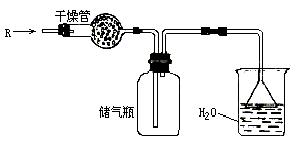
22. 在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是………………………………( )
A.NO B.H2
C.CO D.HCl
![]()
二、填空题(本题共5题,共26分)
23. (5分)实验室可以使用KMnO4和浓盐酸反应制取Cl2。生成产物为MnCl2、KCl、Cl2和H2O。
(1)写出反应的化学方程式并配平:
_________________________________________________________________。
(2)上述反应中,还原剂是________,还原产物是________。
(3)若制取1.12L(标准状况下)的Cl2,在反应中电子转移的数目为_______ _。
24. (6分)久置的浓硝酸发黄是因为__________________________________________;液氨常用做制冷剂,其原因为_________________________________________________;通常情况下,氮气很不活泼,原因为____________________________________________。
25. (4分)现有A、B、C三种气体,A、B无色,C呈红棕色,A在一定条件下能与O2反应生成B,B不溶于水,但却能与O2反应生成C。A和C都能溶于水,前者呈碱性,后者呈酸性,两者水溶液相混合得到D的溶液,请写出A、B、C、D的化学式:
A_____________,B_____________,C_____________,D_____________。
26.(6分) 德国人哈伯因研究出合成氨以及生产硝酸的技术而享誉世界,其结果产生了两方面的影响,一是粮食大量增产;二是可以制造炸药。恰恰因为这两项技术,使德国在一次世界大战中更加凶恶,为欧洲人民增添了苦难。哈伯为此得到德皇的赞赏,随后他又研制出了毒气弹,直接替战争效力。哈伯的妻子克拉克夫人因丈夫的罪过而痛苦,以死来唤起哈伯的良知,但哈伯依然我行我素,又研究出毒性更强的芥子气。克拉克夫人的灵魂永远不会原谅哈伯的,尽管他后来在1918年获得了诺贝尔化学奖。
(1)目前以铁触媒合成氨生产选择的条件是(填编号)______________。
a、200~500Pa b、20~50MPa c、500℃ d、200℃
(2)以氨气、空气、水为原料可以用来制备硝酸铵,写出该反应的第一步氨催化氧化的化学方程式____________________________________________。
(3)浓氨水可以用作工业生产氯化氢的管道检漏剂,其原理用化学方程式表示为___________________________________。
27. (5分)下表列出三种金属的资料,利用这些资料及常识选择恰当的选项填空:
| 金属 | 导电性 | 成本(¥/kg) | 密度 (g/cm3) | 强度 |
| 银 | 很好 | 2000 | 10.5 | 差 |
| 铝 | 较好 | 10 | 2.7 | 好 |
| 钢铁 | 一般 | 1.7 | 7.9 | 好 |
a.质轻 b.美观 c.成本低 d.强度高 e.导电性好 f.易腐蚀 g.成本高
(1)银是电的良导体,但高压线用铝而不用银制的原因是___ ______。
(2)钢铁常用于建筑材料的理由是_________;用钢铁作材料的缺点是_________。
(3)在高压开关中,常用银作开关的接触点,其理由是_________。
(4)学校颁发的奖杯通常是以钢铁制造,然后表面镀上一薄层银。在表面镀银的理由是_____ ____。
![]() 三、实验题(本题共2题,共16分)
三、实验题(本题共2题,共16分)
28.(5分)实验室用固-固加热法制取氨气的化学试剂为(写名称) ;反应的化学方程式为 ;制得的氨可以用 法收集,通常用 检验氨气。
29.(11分)以下是关于“外界因素对化学平衡移动影响的实验研究”的课题,回答问题:
(1)影响化学平衡的因素的界定:化学平衡发生移动的本质原因是__ _ ___ __,所以影响化学平衡的因素可以从分析影响该原因的因素入手。
(2)研究的思路与方法
①研究对象的选择
有以下可逆反应:
A.2NO2(g)![]() N2O4(g)+Q
N2O4(g)+Q
B.FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl
其中,A适合于研究_________对平衡的影响,B适合于研究_________对平衡的影响。(填序号:a浓度、b温度、c压强)
②研究方法:采用控制其它因素不变,改变其中一个因素的方法,并进行对比实验。
(3)单一因素对化学平衡移动影响的实验研究
a.浓度:将FeCl3与KSCN反应后所得的混合液分为3等份,分别加入浓FeCl3溶液、浓KSCN溶液、NaOH固体,观察现象。
现象:加入浓FeCl3溶液后的混合溶液红色_________;加入浓KSCN溶液后混合溶液红色_________;加入NaOH固体后,混合溶液红色_________。
b.温度:将密封并相互连通的盛有NO2的2个玻璃球,1个放入热水中,另一个放入冷水中。
现象:放入热水中的球内红棕色_________;放入冷水中的球内红棕色_________。
(4)综合(3)中研究结果,请总结外界因素对化学平衡影响的规律。
________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
![]()
四、计算题(本题共2题,共14分)
30.(6分)在标准状况下,16.8L氨气物质的量是多少?用一定量的水充分吸收该氨气后,得到体积为60mL的氨水,试计算上述氨水的物质的量浓度。
![]()

31. (8分)将2.88g铜投入80.0mL1.0mol/L的稀硝酸中充分反应:
(1)标准状况下,可以收集到NO气体多少升?
(2)在该反应中发生非氧化还原反应的硝酸的物质的量是多少?
(3)如果向该反应后的溶液中加入100.0mL1.0mol/L的稀硫酸,反应能否继续进行,若能,请计算在标准状况下再次得到气体的体积;若不能,请说明理由。
第一学期高二期中考试
化学试题参考答案及评分标准
(时间90分钟,满分100分)
一、选择题:(每小题2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | B | D | A | C | A | A | B | D | C | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | A | B | A | C | D | C | B | D | C | B | D |
二、填空题:(共26分)
23、(共5分)
(1) 2KMnO4 + 16 HCl → 2KCl + 2 MnCl2+ 5Cl2↑ + 8H2O 2分;
(2) HCl (或氯化氢、盐酸);MnCl2(或二氯化锰) 每空1分
(3)6.02×1022 1分
24、(共6分)
浓硝酸不稳定,见光或受热易分解,生成NO2,溶于硝酸中(或写化学方程式);
氨气易液化;
氮气分子结构中有氮氮三键(或氮分子结构很稳定)。 每空2分
25、(共4分)
NH3、NO、NO2、NH4NO3 每空1分
26、(共6分)
 (1)b、c
2分
(1)b、c
2分
(2) 2分
(3) NH3 + HCl →NH4Cl 2分
27、(共5分,每空1分)
⑴a c d ⑵c d;f ⑶e ⑷b
三、实验题(共16分)
28、(共5分)
氯化铵和碱石灰 1分
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O 2分
向下排空气;湿润的红色石蕊试纸(或湿润的PH试纸) 每空1分
29、(共11分)
⑴ V正≠V逆 (或正反应速度与逆反应速度不相等) 2分
⑵ b c ;a 每空1分
⑶变深;变深;变浅 每空1 分
变深;变浅; 每空1分
⑷如果改变任一个影响平衡的条件(如浓度、压强、温度),平衡就向
能够削弱这种改变的方向移动。 2分
四、计算(共14分)
30、(6分)
n(NH3)=16.8L÷22.4mol/L=0.75mol 3 分
C=0.75mol÷0.060L=12.5mol/L 3分
31、(8分)
(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O 1分
经计算Cu过量
V(NO)=1/4×0.08L×1.0mol/L×22.4L/mol=0.448L 2分
(2)发生非氧化还原反应硝酸的物质的量为:
n(HNO3)=3/4×0.08L×1.0mol/L=0.06mol 2分
(3)能,按下列离子方程式进行计算。 1分
剩余Cu的量为:0.045mol-0.03mol=0.015mol
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
3mol 2mol
0.015mol n
n=(0.015mol×2/3)×22.4L/mol=0.224L 2分
其它正确答案,同样给分。