高二化学下期期末考试能力测试
注意事项:
1、本试卷分第I卷(选择题)和第II卷(非选择题)两部分。第I卷1至2页,第II卷3至6页。选择题的答案作在机读卡上,非选择题的答案作在答题卷相应位置处。考试结束,将机读卡和答题卷一并交回。
2、本试卷共110分,考试时间100分钟。
3、可能用到的相对原子质量:H 1 Al 27 Fe 56
第I卷
(选择题,共8题,每题6分,共48分)
在以下各题的四个选项中只有一个选项符合题意。
1、从世界范围看,空气污染的另一个重大因素是汽车尾气。下列属于汽车尾气但一般不会产生空气污染的是
A、铅和硫氧化合物 B、烃和氮氧化合物
C、水和二氧化碳 D、汞和一氧化碳
2、下列叙述中正确的是
A、金刚石和二氧化硅为同种类型的晶体
B、煤是人类获取芳香烃的唯一来源
C、H+和OH-不能共存
D、![]() 互为同素异形体
互为同素异形体
3、用pH试纸测定某氨基酸溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟标准比色卡对照,测得pH=8,则该氨基酸溶液的实际pH为
A、小于7 B、小于8 C、等于8 D、大于8
4、把![]() 溶液等体积混合,则混合溶液中各离子浓度大小顺序正确的是
溶液等体积混合,则混合溶液中各离子浓度大小顺序正确的是
A、![]()
B、![]()
C、![]()
D、![]()
5、a、b、c、d、e五种无色气体,进行以下实验:①a和b相混合,气体变成红棕色;②c和d相混合,产生白烟;③c和e分别通入少量溴水中,溴水均成无色透明溶液。则a、c、e可能依次是
A、O2、HCl、SO2 B、O2、NH3、CO2
C、NO、NH3、SO2 D、HBr、NH3、C2H6
6、将1.12g铁粉加入到25mL2mol·L-1氯化铁溶液中,充分反应后,下列说法不正确的是
A、铁粉完全溶解 B、生成![]()
C、所得溶液中Fe3+与Fe2+的物质的量浓度之比为6:1
D、在所得的溶液中滴入KSCN溶液后呈血红色
![]() 7、某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:
7、某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:![]()
![]() 。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时,C气体的体积占50%。则下列推断正确的是
。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时,C气体的体积占50%。则下列推断正确的是
A、原混合气体的体积为1.25V
B、原混俣气体的体积为1.5V
C、反应达到平衡时气体A消耗了0.5V
D、反应达到平衡时气体B消耗了0.25V
8、酪氨酸酶分布较广,在许多植物(如香蕉、苹果、蘑菇、马铃薯等)中都含有酪氨酸酶。酪氨酸酶能催化苯酚转化为邻苯二酚,酪氨酸酶还能继续催化邻苯二酚氧化为邻苯二醌,其转化实例如下:
![]()
黑色素是先由酪氨酸酶催化酷氨酸氧化为醌类物质,然后再进行一系列反应而形成的。反应过程如下图所示:
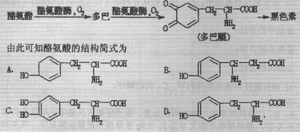
第II卷
(非选择题,共4题,共62分)
9、
I. 某有机物A经过氧化得B(分子式为:C2H3O2Cl),且A在热的NaOH溶液中反应可得C,1molC和2molB反应得到一种含氯的酯。
(1)A的结构简式为: 。
(2)C的氧化产物(分子式为:H2C2O4)与C在一定条件下发生反应生成环状酯,这种酯的名称为: 。
(3)写出1molC与2molB反应的生成物的分子式: 。
II. 今有化合物甲、乙、丙,其结构简式分别如下:
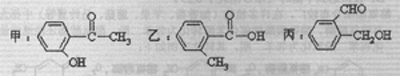
(1)请写出丙中含氧官能团的名称: 。
(2)请判别上述哪些化合物互为同分异构体: 。
(3)请分别写出鉴别甲、乙、丙三种化合物的方法(要求包括操作、现象和结论)。
鉴别甲的方法: ,
鉴别乙的方法: ,
鉴别丙的方法: 。
(4)请按酸性由强至弱排列甲、乙、丙的顺序: 。
10、
A、B、C是同周期的三种短周期元素,原子序数依次递增。A与C的质子数之和为27,最外层电子数之差为5;0.9B单质与足量盐酸反应,收集到气体1.12L(标准状况)。请回答下列问题:
(1)B的元素符号为: 。
(2)写出A的单质与C的单质反应所形成的化合物的电子式:__________。
(3)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(用化学式表示): 。
11、
在含有0.01molHCl和0.01molAlCl3的混合溶液中逐滴加入一定浓度的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积的关系曲线如下图所示。
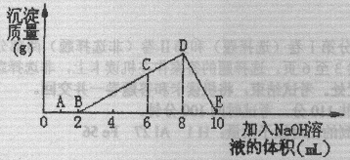
试回答下列问题:
(1)AB段、BD段和DE段所发生的化学反应方程式分别为:
AB: ,BD: ,
DE: 。
(2)分别取B处和E处溶液各少许,混合,可见到的现象是: ,写出发生反应的离子方程式: 。
(3)C处溶液中存在的浓度较大的两种阳离子是 和
(填离子符号),它们的物质的量浓度之比为: (比例顺序与前面所填离子顺序要保持一致)
12、
已知下列数据:
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 98%的浓硫酸 | — | 338.0 | 1.84 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置。
④分离出乙酸乙酯层、洗涤、干燥。
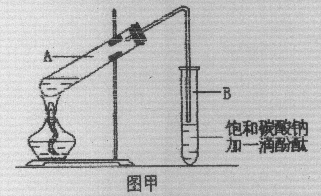
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:
;
写出制取乙酸乙酯的化学方程式:
______________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是(选填字母): 。
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、乙酸乙酯在饱和碳酸钠溶液中溶解度比在水中更小,有利于分层
D、加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:
。
(4)指出步骤③所观察到的现象: ;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去碳酸钠和乙醇等杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母): 。
A、P2O5 B、无水Na2SO4 C、碱石灰 D、NaOH固体
(5)某化学课外小组设计了;图乙所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去)。
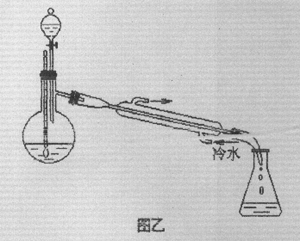
与图甲装置相比,图乙装置的主要优点有:
。