高二化学月考试题
一、选择题(每小题3分,共24分,每小题只有一个选项符合)
![]() 1、反应:A(气)+3B(气) 2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
(
)
1、反应:A(气)+3B(气) 2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
(
)
A、正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B、正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 .
C、正反应速率和逆反应速率都变小,平衡向正反应方向移动
D、正反应速率和逆反应速率都变小,平衡向逆反应方向移动
![]() 2、对于反应2SO2+O2 2SO3,下列判断正确的是
(
)
2、对于反应2SO2+O2 2SO3,下列判断正确的是
(
)
A、2体积SO2和足量O2反应,必定生成2体积SO3
B、其他条件不变,增大压强,平衡必定向右移动
C、平衡时,SO2消耗速度必定等于O2生成速度的两倍
D、平衡时,SO2浓度必定等于O2浓度的两倍
3、已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1· min-1 ,则此段时间内以C的浓度变化表示的化学应速率为( )
A、0.5mol/L·min B、1mol/L·min C、2mol/L·min D、3mol/L·min
![]() 4、某反应mX(g)+nY(g) pZ(g)+
(g)在容积为2L的密闭容器中进行。在2s内用X的浓度的减少表示的平均反应速率为0.3mol/L·s,则2s时Q的增加的物质的量为( )mol
4、某反应mX(g)+nY(g) pZ(g)+
(g)在容积为2L的密闭容器中进行。在2s内用X的浓度的减少表示的平均反应速率为0.3mol/L·s,则2s时Q的增加的物质的量为( )mol
A、0.6q/m B、1.6p/q C、1.2q/m D、0.8p/m
5、在一定的温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1molN2和3molH2,3min后,测得容器中的压强为开始的0.9倍,在此时间内![]() (H2)为
( )
(H2)为
( )
A、0.2 mol·L-1·min –1 B、0.6 mol·L-1·min –1
C、0.1 mol·L-1·min –1 D、0.3 mol·L-1·min -1
![]() 6、在温度不变时,恒容容器中进行反应,H2 2H(正反应为吸热反应),若反应物的浓度由0.1 mol·L-1降到0.06 mol·L-1需20s, 那么由0.06 mol·L-1降到0.036 mol·L-1 ,所需的反应时间为
( )
6、在温度不变时,恒容容器中进行反应,H2 2H(正反应为吸热反应),若反应物的浓度由0.1 mol·L-1降到0.06 mol·L-1需20s, 那么由0.06 mol·L-1降到0.036 mol·L-1 ,所需的反应时间为
( )
A、等于10s B、等于12s C、大于12s D、小于12s
![]() 7、在密闭容器中进行的如下反应,X2(气)+Y2(气) 2Z(气)。已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、
0.3mol·L-1、0.2mol·L-1,在一定条件下,反应达到平衡时,各物质的浓度有可能是
( )
7、在密闭容器中进行的如下反应,X2(气)+Y2(气) 2Z(气)。已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、
0.3mol·L-1、0.2mol·L-1,在一定条件下,反应达到平衡时,各物质的浓度有可能是
( )
A、Z为0.45mol·L-1 B、Y2为0.35mol·L-1
C、X2为0.2mol·L-1 D、Z为0.4mol·L-1
8、常温常压下,将1LNO和1LO2混合,如果压强不变,则混合气体的体积
A、等于2L B、在1~1.5L之间 C、等于1.5L D、在0~1L 之间
二、选择题(每小题3分,共30分。每小题有一个或两个选项符合题意)
![]() 9、恒容下反应2SO2+O2 2SO3,达到平衡后,可以加快反应速率的方法是
9、恒容下反应2SO2+O2 2SO3,达到平衡后,可以加快反应速率的方法是
A、将SO2分离出一部分 B、充入少量N2,增大压强
C、升温 D、充入少量SO3气体
![]() 10、在一定温度下,可逆反应:A(g)+3B(g) 2C(g)达到平衡状态的标志是
10、在一定温度下,可逆反应:A(g)+3B(g) 2C(g)达到平衡状态的标志是
A、C生成的速率与C分解的速率相等 ( )
B、单位时间生成nmolA,同时生成3nmolB
C、 A、B、C的浓度不变化 D、A、B、C的分子数比为1:2:3
11.在容积固定的密闭容器中存在如下反应: A(g)+3B(g) ![]() 2C(g); △H<0 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: ( )
2C(g); △H<0 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: ( )
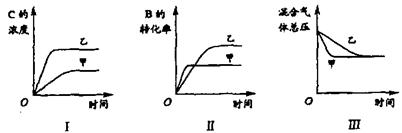
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
![]() 12、可逆反应:3A(g) 3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
12、可逆反应:3A(g) 3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
A. B和C可能都是固体 B . B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C可能都是气体
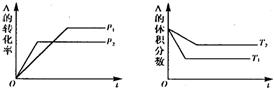 |
A.p1>p2,(a+b)<(c+d),T1<T2,Q>0 B.p1<p2,(a+b)<(c+d),T1>T2,Q<0
C.p1<p2,(a+b)>(c+d),T1>T2,Q<0 D.p1>p2,(a+b)>(c+d),T1<T2,Q>0
14、右图表示外界条件(温度、压强)的变化对下列反应的影响,L(s)+3G(g) 2R(g)(正反应为吸热反应)在图中,y轴是指 ( )
![]()
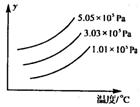 A.平衡混合物中R的百分含量 B.平衡混合物中G的百分含量 C.G的转化率
D.L的物质的量
A.平衡混合物中R的百分含量 B.平衡混合物中G的百分含量 C.G的转化率
D.L的物质的量
![]()
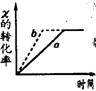 15、a曲线表示一定条件下的可逆反应X(g)+Y(g) 2Z(g)+W(s)的反应过程,若使a曲线变为b曲线,可采取的措施是AD ( )
15、a曲线表示一定条件下的可逆反应X(g)+Y(g) 2Z(g)+W(s)的反应过程,若使a曲线变为b曲线,可采取的措施是AD ( )
A、加入催化剂 B、增大Y的浓度
C、降低温度 D、增大体系压强
![]() 16、已知工业上真空炼铷的原理如下:2RCl(液)+Mg(液) MgCl2(液)+2Rb(气)。对于此反应能给予的正确的解释是
(
)
16、已知工业上真空炼铷的原理如下:2RCl(液)+Mg(液) MgCl2(液)+2Rb(气)。对于此反应能给予的正确的解释是
(
)
A、铷的活动性不如镁强,故镁可置换铷
B、铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C、MgCl2的稳定性不如铷强 D、铷的游离态较化合态更稳定
![]() 17、某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定的条件下发生反应:A(g)+3B(g) 2C(g),若维持温度和压强不变,当达到平衡,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是:①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL ③反应达平衡时气体A消耗掉0.05VL④反应达平衡时气体B消耗掉0.05VL ( )
17、某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定的条件下发生反应:A(g)+3B(g) 2C(g),若维持温度和压强不变,当达到平衡,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是:①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL ③反应达平衡时气体A消耗掉0.05VL④反应达平衡时气体B消耗掉0.05VL ( )
A、②③ B、②④ C、①③ D、①④
18、将装有1mol HI的密闭容器加热,部分HI分解成H2和I2蒸气并达到化学平衡.此时I2的体积分数为x%.若在该容器中加入2mol HI后,加热到相同温度使之达到平衡,设此时I2的体积分数为y%,则x与y的关系为( )
A、x>y B、x<y C、x=y D、x≥y
第Ⅰ卷答案卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共46分)
 三、实验题
三、实验题
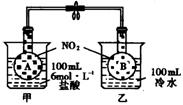
19、(8分)如下图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水。现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解。
(1)A瓶中气体的颜色 ,理由是 。
(2)B瓶中的气体颜色 ,理由是 。
20、(4分)某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右,于是对A和二氧化锰的催化性能进行了定量的对照实验。实验均以收满500ml氧气为准(其它可能影响实验的因素均已忽略)
表一 用MnO2作催化剂
| 实验序号 | KClO3的质量(g) | MnO2的质量(g) | 反应的温度(℃) | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二 用A作催化剂
| 实验序号 | KClO3的质量(g) | A的质量(g) | 反应的温度(℃) | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
请回答:
上述实验中待测数据应是:____________。完成此实验后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目________________________________。
四、填空题
![]()
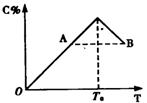 21、(8分)对于反应2A+B 2C,在反应过程中C的百分含量随温度变化如下图所示,则:
21、(8分)对于反应2A+B 2C,在反应过程中C的百分含量随温度变化如下图所示,则:
(1)T![]() 对应的V
对应的V![]() 与V
与V![]() 的关系是
,
的关系是
,
(2)正反应为 热反应
(3)A、B两点的正反应速率的大小关系是 ,
(4)温度下T<T![]() 时,C%逐渐增大的原因是
。
时,C%逐渐增大的原因是
。
![]() 22、(10分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g) 3C(g),已知lmolA和3molB达到平衡后,生成了amolC
22、(10分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g) 3C(g),已知lmolA和3molB达到平衡后,生成了amolC
(1)达到平衡时,C在反应混和气体中的体积分数是 (用字母a表示)
(2)在相同的实验条件下,若在同一容器中改变为加入2molA和6molB,达到平衡后,C的物质的量为______mol(用字母a表示).此时在反应混和物中C的体积分数____(填“增大”,“减小”或“不变”).
(3)在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后在反应混合气体中C的体积分数不变,则还应加入______molC.
(4)在同一容器中加nmolA和3nmolB,则平衡时C的物质的量为mmol.若改变实验条件,可以使C的物质的量在m~2m之间变化,那么,n与m的关系是_____(用字母n、m表示)
23(4分)下列事实不能用勒沙特列原理解释的是 _________
①氨水应密闭保存,放置低温处;②在硫酸亚铁溶液中加入铁粉以防止氧化变质;③实验室常用排饱和食盐水的方法收集氯气;④向饱和的氢氧化钙溶液中加入氢氧化钠溶液析出白色的固体;⑤MnO2能加速H2O2的分解;⑥合成氨时温度选择为500℃。
五、(计算题)
24、(6分)在一定的温度、压强和有催化剂存在的条件下,将N2和H2按1:3的体积比混合,当反应达平衡时,混合气体中含有mmol的NH3,且NH3的体积分数为a%,求起始时N2和H2的物质的量各为多少mol?
25、(6分)在一定条件下,二氧化硫和氧气发生如下反应:
![]() 2SO2(g)+ O2
(g)
2SO3(g) +
Q (Q>0)
2SO2(g)+ O2
(g)
2SO3(g) +
Q (Q>0)
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达),10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
参考答案
1、C 2、C 3、C 4、C 5、C 6、C 7、B 8、B 9、CD 10、A C
11、AB 12、CD 13、B 14、AC 15、AD 16、B 17 、A 18、C
19、(1)变深 盐酸与氢氧化钠发生中和反应,放出热量,使平衡向生成NO2的方向移动。
(2)变浅 NH4NO3溶于水吸热,使温度降低,使平衡向生成N2O4方向移动。
20、时间 金属氧化物A与MnO2催化KClO3分解的比较.
21、(1)V![]() =V
=V![]() (2)放热 (3)A<B (4)反应向正向进行
(2)放热 (3)A<B (4)反应向正向进行
22、(1)25a% (2)2a;不变 (3)6 (4)n>2m/3
23、②⑤⑥
24、、设反应前N2和H2的物质的量分别为amol和3amol,由反应:
![]() N2 + 3H2 2NH3
物质的量的减少
N2 + 3H2 2NH3
物质的量的减少
1mol 3mol 2mol 2mol
mmol mmol (2分)
达平衡后气体的物质的量为:mmol/a%=100mmol/a![]() 反应前的气体的物质的量为:4a=100mmol/a+mmol a=25mmol/a+0.25mmol
反应前的气体的物质的量为:4a=100mmol/a+mmol a=25mmol/a+0.25mmol
即N2、H2的物质的量分别为:
25mmol/a+0.25mmol、 3(25mmol/a+0.25mmol)(4分)
25、(1)增大、减小 (2分) (2)15-20min 25-30min (2分)
(3)增加O2的浓度 a、b (2分)