高二基础会考化学科调研试题
第I卷 选择题(共48分)
一、选择题:(每题只有一个正确答案,每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
 1.右图是椰树牌矿泉水外包装的局部,其中的锶、钠、钙、镁、钾指的是
1.右图是椰树牌矿泉水外包装的局部,其中的锶、钠、钙、镁、钾指的是
A.元素 B.原子
C.离子 D.盐类
2、市场上销售的“84”消毒液,其商品标识上有如下叙述:本品为无色溶液,不显酸性;使用时可加水稀释;可对餐具、衣物进行消毒,可漂白浅色衣物。根据以上描述,你认为该消毒液的有效成分可能是( )
A、Cl2 B、SO2 C、NaClO D、KMnO4
2.根据你对下列物质性质的了解,试判断在自然界中能稳定存在的物质是
A、钠 B、氧化钠 C、过氧化钠 D、氯化钠
3.如图所示,在下列实验操作中正确的是
4.下列叙述不正确的是
A、硫酸的摩尔质量是98 g/ mol
B、0.5 molH2O中所含的H2O分子数为3.01×1023
C、标准状况下,6.02×1023个CO2所占的体积约是22.4L
D、将5.85g NaCl加入1L水中溶解,即配制得到0.1mol/L的NaCl溶液
5.下列各组物质中,互为同位素的是
A、氧气与臭氧 B、正丁烷与异丁烷
C、11H与21H D、金刚石与C60
6.下列现象中,与胶体的性质无关的是
A、把盐卤或石膏加入豆浆制成豆腐
B、放电影时,可以看到由放映室射到银幕上的光柱
C、清晨,人们经常看到阳光穿过茂密的森林时产生的美丽景象
D、BaCl2溶液与稀硫酸混合,立刻产生大量白色沉淀
7.下列物质中,属于电解质的是
A、铜 B、NaOH C、蔗糖 D、酒精
8.一定温度下,某一密闭恒容的容器内可逆反应N2(g) + 3H2(g) === 2NH3(g)达到平衡状态的标志是
A、NH3的生成速率与NH3的分解速率相等
B、容器内混合气体的密度不随时间而变化
C、单位时间内生成1mol N2,同时生成3mol H2
D、A、B、C的分子数之比为1:3:2
9.下列物质中,只有共价键的是
A. NaOH B. NaCl C. NH4Cl D. H2O
10.下列情况会对人体健康造成较大危害的是
A、用SO2漂白食品
B、自来水中通入少量Cl2进行杀菌消毒 (换一个答案)
C、用米醋清洗热水瓶胆内壁附着的水垢(含CaCO3)
D、用小苏打(NaHCO3)发酵面团,制作馒头
11.下列说法正确的是( )
A、电能转化为化学能 B.铜片上产生大量的气泡
C.原电池中锌是正极,发生还原反应 D.溶液的pH值减小
12.下列物质既能与盐酸反应放出气体,又能与氢氧化钠溶液反应放出气体
的是
A、Al(OH)3 B、Al2O3 C、Al D、NaHCO3
13.下列操作不能改变化学反应速率的是
A、把食物储存在冰箱里
B、把铁丝做成螺旋状再燃烧
C、实验室制备氢气用粗锌代替纯锌
D、用2mol/L 50mL的硫酸代替2mol/L 10mL的硫酸与大小、形状、纯度
相同的锌粒反应
14.铂在元素周期表中的表示如右图所示,下列叙述不正确的是
|
B、铂的化学性质很活泼
C、铂为过渡金属元素
D、铂原子最外层有1个电子
15.下列化学反应属于氧化还原反应的是
A.2KOH+H2SO4 = K2SO4+2H2O
B.2H2O2== 2H2O+O2
C.CO2+2NaOH == Na2CO3+H2O
D.NH3+HCl == NH4Cl
16.不能鉴别甲烷和乙烯气体的方法是
A.将两种气体分别用导管导出,在空气中点燃,观察是否有烟
B.将气体分别通入溴的四氯化碳溶液
C.将气体分别通入酸性高锰酸钾溶液中
D.将两气体分别通入澄清的石灰水
17.在下列各用途中,利用了物质的氧化性的是
A、用食盐腌渍食物 B、用盐酸除去铁钉表面的铁锈
C、用汽油擦洗衣料上的油污 D、用漂粉精消毒游泳池中的水
第II卷(共52分)
17.(10分)
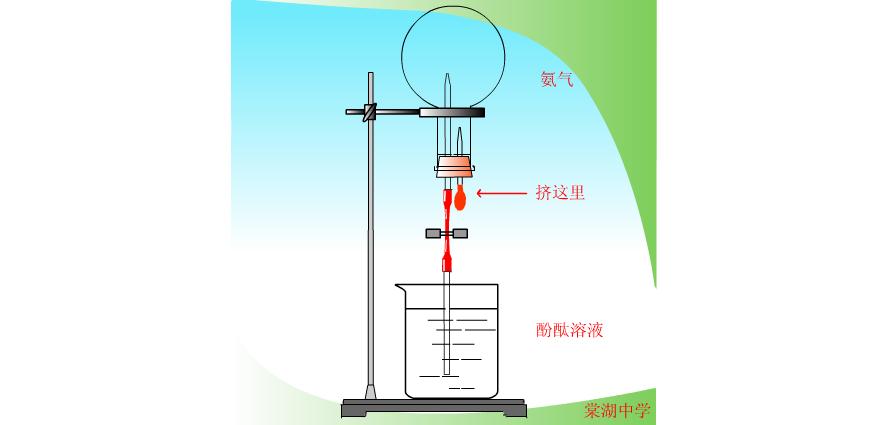
(1)上述实验非常有趣,想必给同学们留下了深刻的印象。请填写下表
| 实验现象 | 体现了氨的什么性质 | 反应方程式 |
(2)人们对化学反应的利用也主要表现在两个方面:制备新物质和获取能量。请仿照示例填写下列表格
| 序号 | 各种化学变化 | 制备新物质或能量转换 |
| (1) | (示例)晚上,点燃蜡烛照明 | 化学能转变为光能 |
| (2) | (示例)利用氢气和氯气合成盐酸 | 制备新物质 |
| (3) | 从铁矿石中冶炼铁 | |
| (4) | 实验室用酒精灯加热 |
(3)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂。硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁。请设计实验验证某硫酸亚铁药品是否被氧化。(写出主要步骤和实验现象)
18.(10分)元素周期律的发现、元素周期表的制定极大地推动了人们对物质世界的认识。下表是元素周期表的前三周期:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | B | ||||||
| 二 | C | D | E | F | ||||
| 三 | G | H | I | J | K | L | M | N |
回答下列问题:
(1)写出下列元素的元素符号: H、 N、 ___。
(2)J元素在元素周期表中的位置是 周期, 族。
(3)比较L元素与M元素非金属性的强弱 。并用两例实验事实说明。
(4)写出元素E的两种同素异形体的化学式 。
以下为选做题,请同学们认真阅读下文之后再答题
(1)19、20题为选修1《化学与生活》内容,每题16分 。
(2)21、22题为选修5《有机化学基础》内容,每题16分。
(3)23、24题为选修2《化学与技术》内容,每题16分。
你只能从上述3个选修模块的试题中选择其中一个模块做答。你选择的模块是 。(务必写清楚模块名称)
《化学与生活》模块
19、(16分)人类只有一个地球,保护我们的生存环境。请解答下列有关环境的问题的选择题:
(1)垃圾是放错了位置的资源,近年来,许多城市逐步实现了生活垃圾分类投放的办法,其中塑料袋、废纸、旧橡胶制品属于( )
A、无机物 B、有机化合物 C、盐类 D、非金属单质
(2)近年来,装饰材料进入家庭,调查发现经过装修的居室中由装饰材料缓慢释放出来的化学污染物浓度过高,影响健康,这些污染物中最常见的是( )
A、一氧化碳 B、二氧化硫
C、甲醛、苯等有机物蒸气 D、臭氧
(3)下列所述情况中,可能引起水污染的是( )
①城市生活污水的任意排放 ②农业生产中农药、化肥使用不当 ③海上油轮石油泄漏 ④工业生产中废液、废渣、废气的排放
A、只有①③ B、只有①④ C、只有②④ D、①②③④
(4)金属腐蚀
20、 (16分)我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)长期生活在缺碘山区,又得不到碘盐供应,易患( )
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(2)可用盐酸酸化的碘化钾淀粉溶液,检验食盐中含碘酸钾。反应的化学方程式为
5KI + KIO3 + 6HCl == 3I2 + 6KCl + 3H2O
其中氧化剂是 ,还原剂是 。(填写化学式)
(3)
《有机化学基础》模块
21、(16分)(1)现有五种有机物:
A、乙烯 B、溴乙烷 C、葡萄糖 D、乙醛 E、乙酸。其中(填写序号):
①能跟银氨溶液发生银镜反应的是 。
②在常温下能跟溴水发生加成反应的是 。
④在一定条件下能发生加聚反应合成聚乙烯的是 。
(2)2002年诺贝尔化学奖授予利用“质谱分析法”和“核磁共振技术”等对生物大分子进行研究并做出重要贡献的科学家。下列物质中,属于生物大分子的是( )
A、乙醇 B、葡萄糖 C、氨基酸 D、蛋白质
(3)有机化合物分子中原子间或原子团间(或原子与原子团间)的相互影响会导致物质化学性质的不同。苯酚分子中由于苯环与羟基的相互影响,因而具有很独特的性质。欲除去混在苯中的少量苯酚,下列实验方法正确的是( )
A、分液
B、加入NaOH溶液后,充分振荡,静置后分液
C、加入FeCl3溶液后,过滤
D、加入过量的溴水,过滤
(4)下列制品中,其主要成分为天然高分子化合物的是( )
A、丝绸 B、轮胎 C、塑料拖鞋 D、动物油脂
22、(16分)研究有机化合物的结构一般要经过以下几个步骤:
 |
| |||


(1)现有一种有机化合物,经实验测得由碳、氢、氧三种元素组成,且三种元素的原子个数比为2∶6∶1。则这种有机物的实验式为 。
(2)又经实验测得在相同温度、相同压强下,该有机物的蒸气的密度是氢气的23倍。则这种有机物的分子式为 。
(3)某同学对此有机物进行了进一步的实验,取试样加水配成溶液,……。据此,确定该有机物的名称,并写出其结构式。
分子组成为C2H6O的有机物A是中性液体。
(1)该液体与金属钠反应放出氢气,A中有官能团 存在,其结构简式可能是 ;
(2)在A中加入浓硫酸加热,生成气态烃B,将B通入溴水,溴水褪色,生成油状物C,则B的结构简式是 ,写出由B生成C的化学方程式
为 ;
(3)在A中加入浓硫酸及醋酸并加热,生成一种有香味的物质D,写出A转化
为D的化学方程式 。
《化学与技术》模块
23.选择题(16分,每小题只有一个正确选项)
硫酸工业、合成氨工业、石油化学工业等在国民经济中占有重要地位。请回答下列问题
(1)硫酸是基本的化工原料,产量大。下列关于硫酸的生产的做法,您认为不合理的是( )
A、厂址应避免在人口稠密的居民区、旅游景点和文物保护区。
B、建筑高烟囱,使尾气在高空扩散稀释。
C、设置“废热”锅炉产生蒸气来供热或发电。
D、通过改进生产工艺,使二氧化硫充分转化,减少尾气的含硫量,达到排放标准。
(2)氨的合成是一个可逆反应,为了探索合成氨的最佳条件,人们进行了大量的研究。下列有关做法不适宜的是( )
A、常采用循环法,使未转化的氮气和氢气得到充分的利用。
B、综合考虑和方面的影响,压强控制在20—50MPa之间为宜
C、利用电解水制取氢气,作为合成氨的原料。
D、使用铁触媒为催化剂,在500℃时获得最大催化效益。
(3)下列有关石油化工的说法正确的是( )
①通过裂化从石油中获得更多的轻质燃油。
②裂解是深度裂化,目的是获得以短链不饱和烃为主要成分的基本化工原料。
③催化重整就是在催化剂的作用下,使汽油中烃分子的结构进行重新排列形成新的分子结构,以提高汽油的品质。
④利用共聚技术可以改进高分子材料的性能。
A、①②③ B、②③ C、①③④ D、①②③④
(4)下列说法中,不正确的是( )
A、直接排放未经处理的造纸工业废水
B、蒸馏法是海水淡化的主要方法之一,此法的缺点是能耗大,将发电厂等工业余热用于海水淡化是经济合理的途径。
C、对自然界的水进行不同的技术处理,可以获得各种要求的水。水处理技术的核心是减少或除去水中的各种离子。
D、海水综合利用,可将海水淡化与制食盐及氯碱工业、镁工业、钾工业、溴工业等形成联合工业体系。
海南省有广阔的海域,海水资源十分丰富。海水的淡化、从海水中提取盐
24.填空题(16分)
(1)电镀是一种常见的金属保护方法,现要在铁制品上镀铜,选用的阳极材料为 ,电镀液为 。
(2)我国著名化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
 |
①上述生产纯碱的方法称 ,副产品的化学式为 。
②沉淀池中发生的化学反应方程式是 。
③使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
《化学与技术》
23、选择题(每小题只有一个正确选项,共16分)
合成氨工业、纯碱工业、石油化学工业等在国民经济中占有重要地位。请回答下列问题
(1)催化剂的研制与使用对促进化学工业的发展有着重大的作用。下列关于合成氨工业中催化剂的说法不正确的是( )
A、使用催化剂是为了提高反应速率
B、使用铁触媒催化剂,在500℃时获得最大催化效益
C、合成氨只能用铁触媒作催化剂
D、除去原料气中的有害物质是为了防止催化剂中毒
(2)下面有关联合制碱法(又称侯氏制碱法)的说法不正确的是( )
A、联合制碱法将氯化钠的利用率由75%提高到95%以上
B、联合制碱法的缺点在于副产品是氯化钙,难以处理
C、联合制碱法将纯碱生产与合成氨生产联合起来,使各种原料得到了充分的利用
D、联合制碱法是由我国著名化工专家侯德榜首次在国际上提出来的
(3)下列关于石油化工或煤的综合利用的说法正确的是( )
① 把煤加工成燃油,就是通过化学反应把煤所含的碳氢化合物转换成汽油、柴油等燃油的过程。
② 裂解是深度裂化,目的是获得以短链不饱和烃为主的基本有机化工原料
③ 乙烯的产量是衡量一个国家石油化工发展水平的标志
④ 煤的气化和液化是使煤变成清洁能源的有效途径
A.①② B.①③④ C.①②③ D.①②③④
(4)随着工业的发展、人口的剧增,淡水资源短缺的问题日益突显。人们将目光投向了大海,下列关于海水淡化的说法中,不正确的是( )
A、蒸馏法、电渗析法是海水淡化的常用方法
B、海水淡化技术的进一步发展将彻底解决水资源危机问题
C、蒸馏法淡化海水的特点是设备结构简单、易操作,但消耗能量大
D、海水综合利用,可将海水淡化与制食盐及氯碱工业、镁工业、钾工业、溴工业等形成联合工业体系
24、填空题(16分)
(1)海南省石碌铁矿盛产赤铁矿(主要成分为三氧化二铁),写出以赤铁矿石为原料炼铁的主要化学反应的方程式 。
从炼铁高炉中出来的生铁经过一系列的加工成为铁制品,现要在铁制品上镀一层锌,选用的阳极材料为 ,电镀液为 。
(2)硫酸是基本的化工原料,产量大。接触法生产硫酸的主要阶段为 , , 。
某地硫铁矿资源丰富,水源充足,交通便利,风景秀丽,文物古迹较多,人口密集。如果在此地建造硫酸厂,有何利弊?
。
23、(1)C (2)B (3)D (4)B
24、(1)Fe2O3 + 3CO == 2Fe + 3CO2
锌(或Zn)、硫酸锌(或ZnSO4)(氯化锌、硝酸锌均可)
(2)二氧化硫炉气的制造、二氧化硫的催化氧化、三氧化硫有吸收
利:原料丰富、水源充足、交通便利;
弊:人口密集、文物古迹较多(危害人的健康、破坏文物)。