高二化学试卷(文科)
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23
Mg-24 Al—27
第Ι卷(选择题共52分)
一、选择题(共52分,每小题只有一个选项符合题意。)
1.关于金属的性质叙述,正确的是( )
A.金属都是银白色的 B.常温下,所有金属都是固体
C.大多数金属有金属光泽,是电和热的良导体 D.金属的熔沸点都很高
2.下列各组物质属于同位素的是( )
A.35Cl和37Cl B. O2和O3 C.金刚石和C60 D.白磷和红磷
3.下列物质属于纯净物的是 ( )
A.碱石灰 B.盐酸 C.铝热剂 D.硝酸银
4.浓硝酸不具有的性质是 ( )
A.酸性 B.氧化性 C.不稳定性 D.难挥发性
5.下列有机物中,不溶于水的是 ( )
A.苯 B.乙醇 C.乙醛 D.乙酸
6.下列化合物中,属于弱电解质的是 ( )
A.HCl B.H2O C.KOH D.CH3COONa
7.向新制氢氧化铜悬浊液中加入适量某有机物的无色溶液,加热时有红色沉淀
产生,说明该有机物中含有 ( )
A.—OH B.—CHO C.—C≡C— D.—COOH
8.下列盐的水溶液呈酸性的是 ( )
A.氯化铵 B.氯化钾 C.碳酸钠 D.醋酸钠
9.下列各组离子在溶液中能够同时大量存在的是( )
A. Cu2+、K+、SO42-、NO3- B.NH4+、Ba2+、SO42-、Cl-
C.Na+、K+、H+、CO32- D.Fe2+、Cu2+、H+、NO3-
10.A、B、C都是金属,把A放入C盐溶液时,A的表面附着一层C;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B C.B>A>C D.B>C>
11.1mol某气态烃完全燃烧,生成3molCO2和2molH2O,此烃是 ( )
A.C3H4 B.C3H6 C.C3H8 D.C4H10
12.相同质量的镁和铝,分别跟足量的盐酸反应,生成氢气的体积比为( )
A.1:1 B.1:2 C.2:3 D.3:4
13.下列金属的冶炼的方法不正确的是 ( )
A. 炼铁用还原剂CO B. 用热分解法制汞
C. 铝的冶炼一般用还原剂法 D. 钠的冶炼用电解法
14.甲烷和氯气发生取代反应时,其生成的有机物可有( )
A. 1种 B. 2种 C. 3种 D. 4种
15.某有机物燃烧后的产物只有二氧化碳和水,关于该有机物的判断正确的
是( )
A. 该有机物一定是烃 B.该有机物一定含碳、氢元素
C. 该有机物一定含碳、氢、氧三种元素 D.该有机物分子内一定只含碳碳单键
16.下列有机物中,不可能发生加成反应的是( )
A、C2H6 B、CH2=CH2 C、CH3CHO D、苯
17.某同学在实验报告中有以下实验数据:①用托盘天平称取11.7g食盐,②用
量筒量取5.26mL盐酸,③用pH试纸测得溶液的pH是3.5,④用标准NaOH溶
液滴定未知浓度的HCl溶液用去23.10mL溶液。其中数据合理的是( )
A.①④ B.②③ C.①③ D.②④
18.使用铝盐和碱反应制取Al(OH)3,最适当的碱是( )
A.NaOH B.Na2CO3 C.NH3·H2O D.Ca(OH)2
19.常温下,能盛放在铝制容器里的物质是( )
A.浓HCl B.浓H2SO4 C.稀HNO3 D.CuCl2溶液
20.在2A+B![]() 3C+4D反应中,表示该反应速率最快的数据是
( )
3C+4D反应中,表示该反应速率最快的数据是
( )
A.vA = 0.5mol/(L·s) B.vB = 0.3mol/(L·s)
C.vC = 0.8mol/(L·s) D.vD = 1mol/(L·s)
21.下列离子方程式书写错误的是( )
A.碳酸钙与盐酸反应:CaCO3 +2 H+=Ca2++H2O+CO2↑
B.铁跟氯化铜溶液反应;Fe + Cu2+ = Fe2+ + Cu
C.氢氧化钡溶液滴入硫酸溶液中:Ba2++SO42—=BaSO4↓
D.醋酸加入氢氧化钠溶液中:CH3COOH+OH—=H2O+CH3COO-
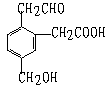 22. 某有机物的结构式如右它在一定条件下能发生的反应有
22. 某有机物的结构式如右它在一定条件下能发生的反应有
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A、②③④ B、①③⑤⑥
C、①③④⑤ D、②③④⑤⑥
23.向AlCl3溶液中逐滴加入NaOH溶液至过量,反应过程中可观察到的现象
是( )
A.有无色气体放出
B.先产生白色沉淀,最后沉淀溶解
C.先产生白色沉淀,最后沉淀不溶解
D.既有无色气体放出,又有白色沉淀生成
24.在某一化学反应中,反应物A的浓度在15 s内从3.0 mol/L变成1.5 mol/L,
在这15 s内A的化学反应速率为 ( )
A.1.5 mol/(L·s) B.1.5 mol/L
C.0.1 mol/(L·s) D.0.1 mol/L
25.在一定条件下,对于密闭容器中进行的可逆反应:
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A. 正、逆反应速率都等于零
B.SO2、O2、SO3在容器中共存
C.SO2、O2、SO3的浓度相等
D.SO2、O2、SO3的浓度不再变化
26.取两份铝粉,第1份加入足量的盐酸,第2份加入足量的氢氧化钠,如果放
出等体积气体,两份铝粉的质量之比为( )
A.1:2 B.1:3 C.3:2 D.1:1
![]() 第Ι卷(选择题共52分)
第Ι卷(选择题共52分)
一、 选择题(共52分,每小题只有一个选项符合题意。)
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
|
| |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 |
第Ⅱ卷(非选择题共48分)
二、填空题(共32分)
27.(3分) 红热的铁与水蒸气可发生反应: 3Fe + 4H2O(g) △ Fe3O4 + 4H2,其中,作为氧化剂的物质是_________(填化学式),作为还原剂的物质是_________(填化学式)。在该反应中,若消耗了3 mol Fe,则生成______mol H2。
28.(4分) 在①甲烷、②乙烯、③乙炔、④苯四种物质中,可以作为植物生长调节剂,用于催熟果实的是_______(填序号,下同);分子结构中含有碳碳三键的是______;不能使酸性高锰酸钾溶液褪色的是_______。
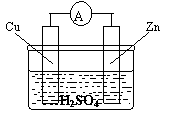 29.(5分)右图是一个铜锌原电池的示意图,则该原电池中作负极的金属是_________,被氧化的电极是_________,发生还原反应的电极是
,该反应的总化学方程式为_________________
_。
29.(5分)右图是一个铜锌原电池的示意图,则该原电池中作负极的金属是_________,被氧化的电极是_________,发生还原反应的电极是
,该反应的总化学方程式为_________________
_。
30(4分).反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)(正反应是放热反应)已达平衡。
CO2(g)+H2(g)(正反应是放热反应)已达平衡。
(1)通入过量的水蒸气,平衡 移动。
(2)减少CO的浓度,平衡 移动。
(3)增大平衡体系的压强,平衡 移动。
(4)使用催化剂,平衡 移动。
31.(8分)甲烷的分子式为 ,电子式为 ,结构式 ;丁烷有 种同分异构体,在系统命名法中,它们的名称分别是 、 。
烷烃的通式是 ;烯烃的通式是 。
32.(8分)写出下列化学反应变化的方程式
(1)实验室制取乙烯的反应
,
该反应属于 反应。
(2)乙醛与氢气在催化剂及加压、加热的条件下的反应
该反应属于 反应。
(3)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)
 。
。
三、实验题(共10分)
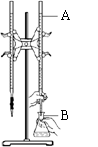
33.(5分) Ⅰ.在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示。请回答:
(1)配制100 mL一定浓度的盐酸,需选用______容量瓶(填字母)。
a.50 mL b.100 mL c.250 mL d.1000 mL
(2)仪器A的名称是_______________________,
其中装入的试剂是______________________。
(3)锥形瓶B中发生反应的离子方程式为
__________________________________。
Ⅱ.(5分) 乙酸是食醋的主要成分,它具有以下化学性质:
 (1)可使紫色石蕊试液变______色,说明乙酸具有______性。
(1)可使紫色石蕊试液变______色,说明乙酸具有______性。
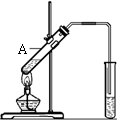
(2)能发生酯化反应。实验室用右图所示装置制取乙酸乙酯,
在试管A中加入的试剂有__________(填写名称)、浓硫酸和
冰醋酸(CH3COOH)。请写出该反应的化学方程式:
______________________________________________。
四、计算题(6分)
34.(6分)实验室可用氨酸钾与浓盐酸反应制取氯气,该反应的化学方程式为:
KClO3+6HCl(浓)====KCl+3H2O+3Cl2↑
现将24.5g KClO3跟150mL 12mol/L(过量)盐酸充分反应,求:
⑴生成的Cl2在标准状况下体积为多少升?
⑵将反应后混合液稀释至500mL,此时溶液中Cl-的物质的量浓度为多少?
(KClO3摩尔质量为122.5g/mol)
化学试卷(文科)答案
一、选择题(共52分,每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | A | D | D | A | B | B | A | A | C | A | D | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 | D | B | A | A | C | B | B | C | C | B | C | D | D |
二.填空题(共32分)
27.(3分)H2O Fe 4
28. (4分)②; ③ ; ①④
29.(每空1分) Zn, Zn, Cu,
(2分) Zn+H2SO4 = ZnSO4+H2↑
30(4分).(1)向右。(2)向左。(3)不。(4)不。
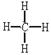
31.(每空1分)1).CH4 , 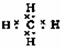 ,
,  ; 2,
丁烷、2-甲基丙烷
; 2,
丁烷、2-甲基丙烷
2)CnH2n+2 , CnH2n ,
32(8分)
(1) CH3CH2OH
![]() CH2═CH2↑ + H2O 消去反应
CH2═CH2↑ + H2O 消去反应
|
(3) Al2O3+2OH-==2AlO2-+H2O
三、实验题(共10分)
33.Ⅰ.(5分)(1)b (2)酸式滴定管 盐酸 (3)H+ + OH- = H2O 2分
Ⅱ.(5分)(1)红 酸 (2)乙醇
CH3COOH + C2H5OH ![]() CH3COOC2H5 +
H2O 2分
CH3COOC2H5 +
H2O 2分
四、计算题(6分)
34.(1)13.44L (2)1.6 mol/L