高二有机化学综合练习(一)
第Ⅰ卷(选择题 共74分)
可能用到的原子量: H-1 C-12 N-14 O-16 Na-23 S-32
一、选择题(本题包括8小题,每题4分,共32分。每小题只有一个选项符合题意)
1.下列各组物质中,全部属于纯净物的是
A.福尔马林、白酒、食醋 B.汽油、淀粉、酚醛树脂
C.石炭酸、盐酸、冰醋酸 D.甘油、乙醇钠、氯仿
2.制冷剂氟氯烃的泄漏会破坏臭氧层。目前过渡性的替代物为氢氟碳化合物,以HFC—nmp代表其分子式,其中n代表分子中碳数减1,例如CHF2CF3为HFC—125,CF3CHFCF3为HFC—227。根据以上说明推断下列叙述不正确的是
A.CF3CF2CF3为HFC—208 B.p代表分子中的氟原子数
C.CH2FCHF2为HFC—143 D. m 代表分子中氢原子数加1
3.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(结构如下)
![]() 下列说法正确的是
下列说法正确的是
A. 羊毛与聚酯纤维的化学成分相同
B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙醇
D.由单体合成聚酯纤维的反应属加聚反应
4.下列各组物质中,互为同系物的是
A. 与 B. 与
C.乙醇与乙二醇 D. 与
5.已知乙酸在一定条件下能生成一种重要的有机试剂M。核磁共振光谱发现M分子中的氢原子没有差别,红外光谱发现M分子里存在羰基,且M分子中所有原子在一个平面上。M极易与水反应重新变为乙酸。则M分子的结构简式可能是
A.CH2=CO B.(CH3CO)2O C.CH3CHO D.HCHO

6.图是一种常见有机物的比例模型,该模型图可代表一种
A.饱和一元醇 B.饱和一元醛
C.羧酸酯 D.羟基酸
7.2004年国家环境保护总局、国家工商行政管理总局等八部委联合发出通知,要求到2005年底黑龙江、吉林、辽宁、河南、安徽五省及湖北、山东、河北和江苏四省的部分地区基本实现乙醇汽油代替其他汽油。下列关于乙醇汽油的说法不正确的是
A.推广使用乙醇汽油有助于减轻大气污染,改善大气环境
B.使用乙醇汽油有助于促进粮食(特别是陈粮)转化,提高农民收入,促进经济发展
C.使用乙醇汽油可大大降低油料价格
D.乙醇是二级能源,也是一种可再生能源
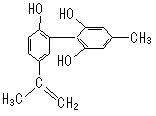 8.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法正确的是
8.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法正确的是
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和 H2
分别为4 mol、7 mol
C.滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中
存在碳碳双键
D.该分子中的所有碳原子不可能共平面
二、选择题(9-16题每题4分,17-18题每题5分)
9.生活中碰到的某些问题常常涉及到化学知识,下列叙述不正确的是
A.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应。
B.只用淀粉溶液即可检验食盐是否为加碘盐。
C.食用松花蛋时蘸些食醋可以去除氨的气味。
D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打溶液或氨水。
10. 可以把6种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液、氢硫酸一一区分的试剂是
A.新制碱性Cu(OH)2悬浊液 B.FeCl3溶液
C.BaCl2溶液 D.酸性KMnO4溶液
11.如下表所示,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
12. 重氮甲烷能与酸性物质反应:R-COOH + CH2N2 → R-COOCH3 + N2,下列物质能与重氮甲烷反应,但产物不是酯的是
A.HCHO B.C6H5CH2OH C.C6H5COOH D.C6H5OH
13. 2005年禽流感在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物。下列有关描述正确的是
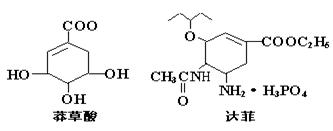 |
A.高温、紫外线都能使禽流感病毒失去生理活性
B.莽草酸既能与H2发生加成,又能与FeCl3溶液反应显紫色
C.莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色
D.1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为4mol
14.2004年美国科学家通过“勇气” 号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是
A.1mol硫化羰在氧气中完全燃烧时转移6mol电子
B.硫化羰可用作灭火剂
C.CO2和COS结构相似,都是非极性分子
D.硫化羰的熔点可能很高
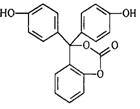 15.某有机物的结构简式如图所示,每个节点代表一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。关于该有机物的说法正确的是:
15.某有机物的结构简式如图所示,每个节点代表一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。关于该有机物的说法正确的是:
A.该有机物的化学式为C20H15O5
B.该有机物分子中的三个苯环不能共平面
C.该有机物可发生加成、取代、氧化、消去、加聚等反应
D.1mol该有机物与足量NaOH 溶液充分反应,溶液NaOH的 物质的量为4mol
16. 青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液。这说明
A.青苹果只含淀粉不含糖类 B.熟苹果只含糖类不含淀粉
C.苹果成熟时淀粉水解为单糖 D.苹果成熟时单糖聚合为淀粉
17. 应用纳米新材料能给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”的主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用。有鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去。若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有
A. 4种 B 5 种 C 6种 D 8种
18. X、Y两种有机物的分子式不同,但均含C、H或C、H、O,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时的耗氧量和生成水的物质的量也分别不变,下列有关判 断正确的是
A.X、Y分子式中氢原子数一定要相同,与碳、氧原子数的多少无关
B.若X为CH4,则分子量最小的Y可能是醋酸或甲酸甲酯
C.若X为CH4,则分子量最小的Y是乙二醇
D.X、Y的分子式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
第Ⅱ卷(共76分)
班级 学号 姓名
请将选择题答案填入下表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 |
|
|
|
|
|
|
|
|
| |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、(本大题包括2小题,共21分)
19.(1)下列实验操作或对实验事实的描述正确的是 (填序号)
①做银镜反应实验的试管在实验前用热碱液洗涤;
②水中含有少量苯和硝基苯,可用活性炭吸附除去;
③ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;
④ 蒸馏石油时,冷凝管中的冷水应上进下出;
⑤准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤玻璃球,放溶液至21.00mL处
⑥检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-。
(2)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。
答:
20.实验室可利用甲醇、空气、铜或氧化铜来制备甲醛,关于甲醇和甲醛的沸点和水溶性见下表:
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水相溶 |
| 甲醛 | -21 | 与水相溶 |
|
请回答:
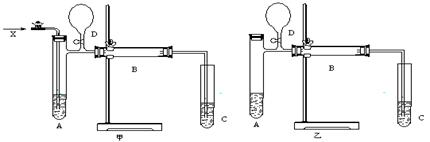
(1)若按甲装置进行实验,则通入A试管的X是__________________,
B管中发生反应的化学方程式为__________________________ 。
(2)若按乙装置进行实验,则B管中应装入__________________,
B管中发生反应的化学方程式为__________________________。
(3)C试管中装入的试剂是____________,管内收集到的物质有__________。
(4)对甲、乙两装置中的A.B.C,还需要采取什么措施(实验室提供用品),才能使实验顺利进行?
对A是___ ____________,对B是____ _________,对C是______________
(5)反应结束时,先打开D处的活塞,然后_________________________
四、(本大题包括2小题,共16分)
21.1945年,美国学者E·G·Rochow在做普通电化学实验中发现:硅-铜合金与有机氯
化物反应生成一类新化合物二氯二甲基硅烷[(CH3)2SiCl2]和三氯甲基硅烷 (CH3SiCl3)。硅烷衍生物的性质和烷烃衍生物相似,但硅保持其在原硅酸中的结构特点。
⑴ 写出二氯二甲基硅烷在氢氧化钠水溶液中反应的化学方程式 ;
⑵ E·G·Rochow在实验中得到的是二氯二甲基硅烷和三氯甲基硅烷的混合物。分析这种混合物的方法如下:把已知质量的混合物密封在安瓿中并放入盛有过量NaOH溶液的厚壁锥形瓶,摇动锥形瓶使安瓿振碎,二氯二甲基硅烷和三氯甲基硅烷分别和NaOH反应。过量的NaOH用盐酸滴定。实验测得空安瓿的质量为4.621 g,安瓿和供分析用的混合物总质量为5.4515 g,加入浓度为0.926 0 mol/L 的NaOH溶液25.00 mL;滴定过量NaOH溶液用去浓度为0.5000 mol/L 的HCl溶液15.44 mL。则混合物中n[(CH3)2SiCl2]= ,n (CH3SiCl3) =
{已知M[(CH3)2SiCl2]=129.0g/mol,M (CH3SiCl3) =149.5g/mol};
22.有机物A与B无论以何种比例混合,只要总的物质的量一定,所得混合物中全部原子的核外电子总数即为定值。若A是分子中含有8个氢原子的烃,B是分子中含有3个碳原子的烃的含氧衍生物。请按要求填空:
(1)若A、B的相对分子质量相等,则A和B的分子式分别是
A:_____________,B_____________。
(2)若A、B的相对分子质量相差2,且B的分子中所有的H原子所处的化学环境完全相同,则A的分子式为_________ __,B的结构简式是__________________
五、(本大题包括2小题,共20分)
23.有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质.
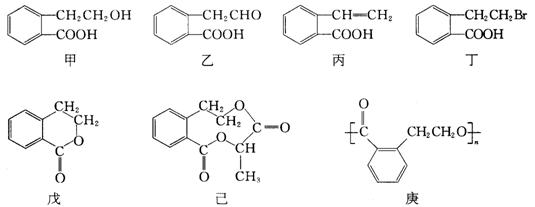
请回答下列问题:
(1)指出反应的类型:
甲→丙:______________________,甲→丁:______________________.
(2)在甲~庚七种物质中,互为同分异构体的是______________________(填代号,多选扣分,下同);可看作酯类的是______________________.
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有原子有可能都在同一平面内的物质是______________________.
24.丙二酸二乙酯[CH2(COOC2H5)2]是有机合成的重要原料。下图是合成丙二酸二乙酯及由丙二酸二乙酯和苯甲醛合成肉桂酸的过程。回答下列问题:
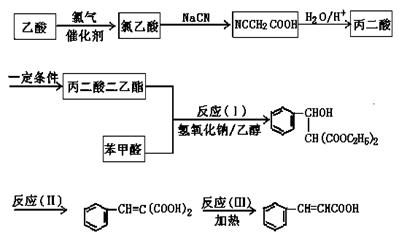
(1)反应(Ⅰ)的反应类型是:______________________,
进行反应(Ⅱ)的适宜条件是____________________,
反应(Ⅲ)的另一种产物的化学式是______________。
(2)乙酸转化为氯乙酸的化学方程式是_____________________________________。
(3)丙二酸转化为丙二酸二乙酯的化学方程式是____________________________。
六、(本大题包括2小题,共19分)
25.科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质。如果将CO2与H2以一定的体积比混合,在一定条件下发生反应,可获得重要的能源物质和水。
(1)标准状况下,将14LCO2和56LH2混合,通入反应器,在适当的条件下恰好完全反应,生成的气体可使碱石灰增重22.5克。则上述反应中可获得一种重要的能源物质是_____________
(2)调整CO2与H2混合时的体积比,可以得到不同的烃类。若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是( )
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(3)用CO2和H2可人工合成CnH2n+2的烷烃,写出该化学方程式并配平:
______________________ __________
(4)已知在443~473K时,用钴(Co)作催化剂可生成C5~C8的烷烃,这是人工合成汽油的方法之一。要达到该汽油的要求,CO2和H2的体积比的取值范围是多少?________________ __________
26. 苹果味饮料是一类由苹果发酵而成的酸性饮品,具有解毒、降脂等效果,其主要酸性物质为苹果酸。苹果酸在分离提纯后的化学分析如下:
①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C、H的质量分数分别为35.82%和4.48%;②1mol该酸与足量的NaHCO3反应放出44.8LCO2,与足量的Na反应放出H2 33.6L(气体体积均为标况);③核磁检测,该分子中存在四种化学环境不同的碳原子,氢原子也处于五种不同的化学环境。
请回答:
(1)分子中有 个羧基,苹果酸分子式为 。
(2)苹果酸的结构简式为 。
(3)苹果酸的同分异构体中符合上述①、②两个条件的有 (写出任一种的结构简式)。
(4)该酸在一定条件下可以发生分子内脱水,(如该脱水的产物能使溴水褪色)其化学方程式为:_____________________________________,反应类型为_________