高二年级化学第一学期第二次月考2
化 学
命题人:周留美
(时间:120分钟 分值:150分) 2
第Ⅰ卷
一、选择题(每题只有一个正确答案。每小题4分,共32分。)
1.下列哪些是影响化学反应速率的主要因素
A.压强 B.温度 C.催化剂 D.反应物的性质
2.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列表示甲醇燃烧热的热化学方程式正确的是
A.CH3OH(l)+![]() O2(g)
O2(g) CO2(g)+2H2O(l) △H=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
3.下列说法正确的是:
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减少或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
4.pH相同的盐酸和醋酸两种溶液中,它们的
A.H+的物质的量相同 B.物质的量浓度相同
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
5.水的电离过程为H2O![]() H+
+ OH—,在25℃时,水的离子积:Kw=1×10—14,在35℃时,水的离子积:Kw=2.1×10—14,则下列关于水的电离的叙述正确的是:
H+
+ OH—,在25℃时,水的离子积:Kw=1×10—14,在35℃时,水的离子积:Kw=2.1×10—14,则下列关于水的电离的叙述正确的是:
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)﹤c(OH—)
C.35℃时的水比25℃时的水电离程度小 D.水的电离是吸热的
6.已知工业上真空炼铷的反应方程式为:2RbCl + Mg![]() MgCl2 + 2Rb(g),对于此反应能够进行解释正确的是
MgCl2 + 2Rb(g),对于此反应能够进行解释正确的是
A.MgCl2的热稳定性差 B.Rb比Mg的金属性弱,故镁可置换铷
C.高温下Mg2+得电子能力比Rb+弱
D.铷的沸点低,当把铷蒸气抽走,可使平衡向正反应方向移动
7.下列说法正确的是
A. pH=7的溶液一定呈中性 B.pH﹤7的溶液一定呈酸性
C.c(H+)=1×10—6 mol ·L-1的溶液一定呈酸性
D.c(H+)>c(OH—)的溶液一定呈酸性
8.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 3Z(g)此反应达到平衡的标志是
3Z(g)此反应达到平衡的标志是
A 容器内压强不随时间变化
B 容器内各物质的浓度不随时间变化
C 容器内X、Y、Z的浓度之比为1︰2︰3
D 单位时间消耗0.1mol X同时生成0.3mol Z
二、选择题(每题有一个或两个正确答案。有错为零分,少选且正确得3分。每小题5分,共40分。)
9.反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增大C的量 B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使体系体积增大
10.反应2A(g)![]() B(g)+xC(g),在一定条件下达到平衡后,容器内压强增大了
B(g)+xC(g),在一定条件下达到平衡后,容器内压强增大了
p%,A的转化率为2p%,则x的值为
A.1 B.2 C.3 D.4.
11.对于可逆反应2AB3(g)
![]() A2(g)+3B2(g);△H>0,下列图像中正确的是
A2(g)+3B2(g);△H>0,下列图像中正确的是
12.在一定的条件下,单独改变可逆反应N2+3H2![]() 2NH3 △H﹤0
的下列条件后,有关的叙述错误的是
2NH3 △H﹤0
的下列条件后,有关的叙述错误的是
A.加入催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.增大压强,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降低温度,v(正)、v(逆)都减小,且v(正)减小的倍数大于v(逆)减小的倍数
D.等容时,加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
13. 在地壳内,深度每增加1 km,压强大约增加25 250 kPa ~30 300 kPa,在这样的压强下,对固体物质的平衡会发生较大影响。如:
CaAl2Si2O8
+ Mg2SiO4![]() CaMg2Al2Si3O12
CaMg2Al2Si3O12
(钙长石) (镁橄榄石)(钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 413.6
密度(g/cm3) 2.70 3.22 3.50
在地壳区域变化的条件下,有利于
A.钙长石生成 B.镁橄榄石生成
C.钙长石和镁橄榄石共存 D.(钙镁)石榴子石生成
14.0.1mol/L的一元酸溶液的pH
A.等于1 B.≦1 C.≧1 D.无法确定
15.若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
A.10:1 B.5:1 C.1:1 D.1:10
16.一定温度下,反应2SO2+O2
![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)
=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol, n(SO3)=1.4mol,此时
SO2的物质的量应是
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
 2006~2007学年度第一学期高二年级第二次月考
2006~2007学年度第一学期高二年级第二次月考
化 学
第Ⅱ卷(共78分)
三、填空题:
17.(6分)下列物质中:①能导电的有( );②属于电解质的有( );③属于非电解质的有( )
A.稀H2SO4 B.氨水 C.酒精 D.液态HCl E.SO2
F.硝酸 G.熔化的CuSO4 H.Cu I.金刚石 J.液氨
18.(6分)写出下列物质的电离方程式
NH3·H20 ; H2C03 ;
Cu(OH)2 ; Na3PO4 ;
NaHSO4 ; NaHC03 。
19.(6分)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气,方程式为:2N2H4+2NO2==3N2+4H2O 已知:
①N2(g)+2O2(g)==2NO2(g) △H= +66.7 kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(g)△H= —534kJ/mol
试计算1mol肼和二氧化氮完全反应时放出的热量为 kJ,写出肼与二氧化氮反应的热化学方程式 。
20.(8分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l)![]() NaCl(l)+K(g)△H>0;
NaCl(l)+K(g)△H>0;
该反应的平衡常数可表示为:K==c(K),各物质的沸点与压强的关系见下表
| 压强/kPa | 13.33 | 53.32 | 101.3 |
| K的沸点/℃ | 590 | 710 | 770 |
| Na的沸点/℃ | 700 | 830 | 890 |
| KCl的沸点/℃ | 1437 | ||
| NaCl的沸点/℃ | 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
21.(6分)实验表明,液态时,纯硫酸的电离能力强于纯硝酸,纯硫酸的导电能力也强于纯水又知液态电解质都有能像水那样自身电离而建立电离平衡(即像2H2O![]() H30++OH—一样),且在一定温度下都有各自的离子积常数,由此回答:
H30++OH—一样),且在一定温度下都有各自的离子积常数,由此回答:
(1)纯硫酸在液态时,自身电离的电离方程式为: ,它在25℃时的离子积常数K(H2SO4)比1×10—14 (填“大”“小”或“相等”)
(2)在纯硫酸和纯硝酸的液态混合物中,存在的阴离子主要是 ;
22.(12分)有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2:1的SO2和O2的混合气,并使A、B容器中气体体积相等。在保持400℃条件下发生反应:2SO2
+ O2![]() 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴达到平衡所需时间A容器比B容器_______,两容器中SO2的转化率A比B_______ 。
⑵达到⑴所述平衡后,若向容器中通入数量不多的等量Ar气,A容器的化学平衡向___________移动,B容器的化学平衡______移动。
⑶达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数______,B容器中SO3的体积分数________
23.(4分)一定条件下,A、B、C的起始浓度分别是a
mol/L、b
mol/L、c
mol/L,可逆反应A(g)
+B(g) ![]() 2C(g)达到平衡,测得c(A)=0.8mol/L、c(B)=0.5mol/L、c(C)=1.2mol/L。请回答:
2C(g)达到平衡,测得c(A)=0.8mol/L、c(B)=0.5mol/L、c(C)=1.2mol/L。请回答:
⑴a、b应满足的条件是_______ _______;
⑵a的取值范围是_____________。
24.(10分)可逆反应3A(g)![]() 3B(?)+C(?);△H<0
达到化学平衡后,升高温度。用“变大”、“变小”、“不变”或“无法确定”填空。
3B(?)+C(?);△H<0
达到化学平衡后,升高温度。用“变大”、“变小”、“不变”或“无法确定”填空。
⑴若B、C都是气体,气体的平均相对分子质量 ;
⑵若B、C都不是气体,气体的平均相对分子质量 ;
⑶若B是气体,C不是气体,气体的平均相对分子质量 ;
⑷若B不是气体,C是气体。
①如果A的摩尔质量大于C的摩尔质量,气体的平均相对分子质量 ;
②如果A的摩尔质量小于C的摩尔质量,气体的平均相对分子质量 。
四、计算题:
25.(10分)设水的电离平衡曲线如图所示:
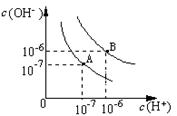 (1)若以A点表示25℃时水的电离平衡时的离子浓度,当温度上升至100℃时,水的电离平衡状态到B点,则此时水的离子积从_____ ___变为_ _。
(1)若以A点表示25℃时水的电离平衡时的离子浓度,当温度上升至100℃时,水的电离平衡状态到B点,则此时水的离子积从_____ ___变为_ _。
(2)25℃把99.5mL0.2mol/LNaOH溶液加到100.5mL0.1mol/L硫酸中,计算所得溶液的pH 。
(3)100℃ 时,pH=8的Ba(OH)2溶液与pH=5的稀HCl混合,欲使混合液的pH=7,计算 Ba(OH)2与HCl的体积比
26.(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。 计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,![]() (N2)∶
(N2)∶![]() (H2)= 。
(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。