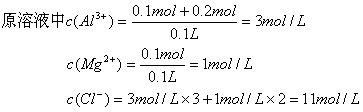高二年级化学上学期期末形成性阶段检测
(理)试卷
相对原子质量:H:1 O:16 Mg:24 Al:27 Fe:56 Cu:64
一.选择题:(每小题2分,共50分,每小题有1~2个正确选项,请将正确答案填涂在机读卡上)
1.下列哪种物质溶于水时,电离出的阳离子能使水的电离平衡向右移动( )
A.HNO3 B.NH3·H2O C.(NH4)2SO4 D.Na2CO3
2.用0.01 mol/L NaOH溶液完全中和pH=3的下列溶液各100 mL,需NaOH溶液的体积最大的是( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
3.下列有关纯铁的描述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在冷的浓硫酸中可钝化
D.在潮湿的空气中比生铁容易被腐蚀
![]() 4.在A+B(g) C反应中,若增加压强或降低温度,B的转化率均增大,则反应体系应是( )
4.在A+B(g) C反应中,若增加压强或降低温度,B的转化率均增大,则反应体系应是( )
A.A是固体,C是气体,正反应吸热
B.A是气体,C是液体,正反应放热
C.A是气体,C是气体,正反应放热
D.A是气体,C是气体,正反应吸热
5.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象相同的是( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Na2CO3和HCl
6.用某种容器对一种液体进行体积计量,设正确读数为n mL,仰视读数为x mL,俯视读数为y mL,若x>n>y,则所用量器是( )
A.量筒 B.酸式滴定管
C.容量瓶 D.碱式滴定管
7.某溶液中加入铝粉能产生氢气,在此溶液中可能大量共存的离子组是( )
A.Ba2+、Na+、OH-、NO3- B.AlO2-、Na+、NO3-、K+
C.Na+、K+、HCO3-、SO42- D.Mg2+、K+、H+、NO3-
8.将pH都是3的醋酸和盐酸分别稀释相同的倍数,两溶液中由水电离出的c(H+)的比值( )
A.等于1 B.小于1 C.大于1 D.无法判断
9.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②③ C.②⑤ D.④⑥
10.将0.2 mol·L-1 HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
A.c(HCN)<c(CN-) B.c(Na+)<c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1 mol/L
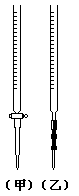 11.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确的选项( )
11.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确的选项( )
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 滴定时选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
![]() 12.反应L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数,据此可推断( )
12.反应L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数,据此可推断( )
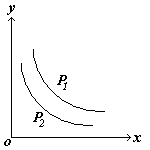 A.上述反应是放热反应
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a<b
13.下列反应的离子方程式正确的是( )
A.铝片和氢氧化钠溶液反应 Al+2OH-=AlO2-+H2↑
B.少量氯气通入FeBr2溶液中 2Fe2++Cl2=2Fe3++2Cl-
C.氢氧化铁放入氢碘酸溶液中 Fe(OH)3+3H+=Fe3++3H2O
D.向Al2(SO4)3溶液中加入Ba(OH)2溶液至沉淀达到最大值
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
14.室温下Va mL pH=4的盐酸跟Vb mL pH=11的氨水混合,所得溶液pH=7,有关混合前两种溶液的体积关系的下列判断正确的是( )
A.Va=0.1Vb B.Va>10Vb C.Va<0.1Vb D.Va=10Vb
15.在一个固定体积的密闭容器中装入A mol N2,B mol H2和催化剂,在一定温度下达到平衡时生成C mol NH3。反应达平衡时和反应前的压强之比是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
16.将铁屑溶于过量盐酸后,再加入下列物质:①硫酸 ②硝酸锌 ③氯化铜④氯水,会产生Fe3+的是( )
A.①④ B.②④ C.只有④ D.①③
17.在一定条件下,合成氨反应到达平衡状态,此时,再进行如下操作,平衡不发生移动的是( )
A.恒温恒容时,充入He B.恒温恒压时,充入He
C.恒温恒压时,充入NH3 D.恒温恒容时,充入N2
![]() 18.现有3个体积相等的密闭容器,都进行下列反应:CO2(g)+H2(g) H2O(g)+CO(g),反应所处的温度相同,但起始浓度不同。其中甲:CO2=H2=a mol;乙:CO2=a mol,H2=2a mol;丙:CO2=H2=H2O(g)=a
mol。达到平衡时,CO的物质的量由大到小的顺序是( )
18.现有3个体积相等的密闭容器,都进行下列反应:CO2(g)+H2(g) H2O(g)+CO(g),反应所处的温度相同,但起始浓度不同。其中甲:CO2=H2=a mol;乙:CO2=a mol,H2=2a mol;丙:CO2=H2=H2O(g)=a
mol。达到平衡时,CO的物质的量由大到小的顺序是( )
A.甲>乙>丙 B.甲>丙>乙 C.乙>丙>甲 D.乙>甲>丙
19.有X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y,X和Z作原电池电极时,Z为正极;Y和Z用导线连接插入H2SO4中,Y上有气泡冒出;M和Y作原电池的电极时,电流由M到Y。则这四种金属的活动性由强到弱的顺序为( )
A.X>Y>Z>M B.X>Z>M>Y
C.M>Z>X>Y D.X>Z>Y>M
20.把一定量的铁和铜的混合物放入一定量的稀硝酸中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则任何情况下,滤液里都一定存在的金属离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.Fe2+、Fe3+
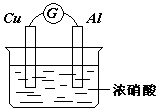 21.有如图所示的装置,下列说法正确的是( )
21.有如图所示的装置,下列说法正确的是( )
A.Cu是原电池的负极
B.Al是原电池的负极
C.电流表的指针偏向铜
D.铝片上的电极反应式为:Al-3e-=Al3+
![]() 22.某恒容密闭容器中放入一定量的NO2,发生下列反应:2NO2(g) N2O4(g)(正反应是放热反应)达到平衡后,若分别改变下列条件,重新达到平衡状态后,能够使混合气体的平均相对分子质量减小的是( )
22.某恒容密闭容器中放入一定量的NO2,发生下列反应:2NO2(g) N2O4(g)(正反应是放热反应)达到平衡后,若分别改变下列条件,重新达到平衡状态后,能够使混合气体的平均相对分子质量减小的是( )
A.通入N2 B.通入NO2 C.升高温度 D.通入N2O4
23.将pH=1的盐酸平均分成2份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水和NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
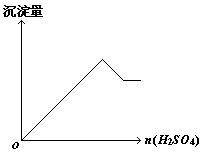 24.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,但所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是( )
24.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,但所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是( )
A.NaAlO2与Na2S2O3的混合溶液
B.Na2S2O3与Na2CO3的混合溶液
C.AlCl3与CuSO4的混合溶液
D.Na2S与Na2SO3的混合溶液
25.将Cu片放入0.1 mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为( )
A.3:2 B.3:5 C.4:3 D.3:4
二.填空题:(共30分,将正确答案写在答题纸上)
26.将一块镁、铝合金中的镁、铝以沉淀形式分开,在下列操作步骤的括号内表示选用试剂的化学式,在方框内表示生成物的化学式:
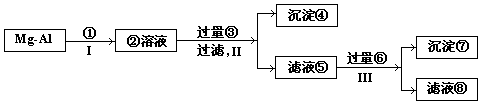
(1)写出下列物质的化学式:
④________________ ⑤_______________ ⑦________________
(2)写出反应II和III的化学方程式:
II___________________________________,_____________________________
III_____________________________________________________
![]() 27.有两个密闭容器A和B,A容器保持恒容,B容器有一个可移动活塞使容器内保持恒压,起始时向两个容器中分别充入等量的NO2,并使A和B容积相等。在保持400℃条件下,使之发生如下反应:2NO2(g)
N2O4(g),填写下列空白:
27.有两个密闭容器A和B,A容器保持恒容,B容器有一个可移动活塞使容器内保持恒压,起始时向两个容器中分别充入等量的NO2,并使A和B容积相等。在保持400℃条件下,使之发生如下反应:2NO2(g)
N2O4(g),填写下列空白:
(1)达到平衡时,所需时间A比B_____________(“长”、“相同”、“短”)
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器的化学平衡______________移动,B容器的化学平衡_____________移动。
![]() (3)达到(1)所述平衡后,向两容器中通入等量的原反应气体,达到平衡后,A中N2O4的体积分数_____________(填“增大”、“减小”、“不变”);B容器中N2O4的体积分数_____________(填“增大”、“减小”、“不变”)。
(3)达到(1)所述平衡后,向两容器中通入等量的原反应气体,达到平衡后,A中N2O4的体积分数_____________(填“增大”、“减小”、“不变”);B容器中N2O4的体积分数_____________(填“增大”、“减小”、“不变”)。
28.(1)今有2H2+O2 2H2O反应,构成燃料电池,则负极通的应是_____________,正极通的应是_____________,电极反应式为:负极_______________________________,正极_______________________________________。
(2)如把KOH溶液改为稀H2SO4作导电物质,则电极反应式为:负极___________________正极_____________________________。
(1)和(2)的电解液不同,反应进行后,其溶液的pH各有什么变化?
①pH变_____________,②pH变_____________。
(3)如把H2改为甲烷,KOH溶液做导电物质,则电极反应式为:
负极______________________________,正极__________________________
29.现有浓度各为1 mol/L的FeCl3,FeCl2,CuCl2混合溶液100 mL,加入一定量的铁粉,对下列情况填空:
(1)反应完毕,铁粉有剩余。反应后的溶液中一定含有________阳离子,是________mol,固体物质烘干后,和反应前加入的铁粉相比,质量_____________(填增加或减少)___________ g。
(2)反应完毕后,无固定沉积物存在,反应后的溶液中一定含有的阳离子中物质的量为定值的是_________阳离子,该值是__________ mol。
三.实验题:(共8分,将正确答案写在答题纸上)
30.用中和滴定法测定某烧碱的纯度。
(1)配制待测液:将1.70 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液所需的主要仪器有____________________________________________________。
(2)滴定时,应先问锥形瓶中加_____________滴_____________作为指示剂;滴定过程中两眼应注视_____________当_____________时为滴定终点。
(3)对几种假定情况的讨论:
①若达到滴定终点时,滴定管还悬着一滴标准液未滴下,则会使测定结果_____________。
②若刚见到指剂局部的颜色有变化停止滴定,则会使测定结果_____________。
③读数时,若滴定前视线偏低,滴定后视线偏高,则会使测定结果_____________。
四.计算题:(共12分,将正确答案写在答题纸上)
31.有硫酸和盐酸的混合液20 mL,向该溶液中加入0.05 mol·L-1的Ba(OH)2溶液时,生成的BaSO4的质量和混合溶液的pH如图所示关系,计算:
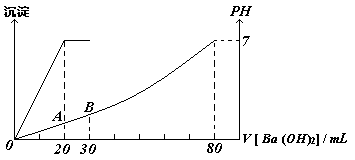
(1)最初混合液中硫酸和盐酸的物质的量浓度。
(2)在B点溶液的pH。
32.将一小块金属钠投入到盛有100 mL氯化镁和氯化铝的混合溶液的烧杯中,发现烧杯中沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44L,同时得到21.4 g沉淀。将此沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6 g。
求:原混合液中Mg2+、Al3+及Cl-的物质的量浓度。
高二年级期末形成性阶段检测
化学(理)试卷答题纸
学校__________班级_________姓名_______________成绩__________
二.填空题:
26.④____________________ ⑤____________________ ⑦____________________
II ______________________________ ______________________________
III ________________________________________
27.(1)__________ (2)__________ __________ (3)__________ __________
28.(1)负极__________ 正极__________
负极______________________________ 正极______________________________
(2)负极_________________________ 正极______________________________
①pH变__________ ②pH变__________
(3)负极_________________________ 正极______________________________
29.(1)__________,__________mol,__________,__________g
(2)__________,__________mol。
三.实验题:
30.(1)____________________________________________________________
(2)__________,__________,____________________,____________________
(3)①__________________ ②__________________ ③__________________
四.计算题:
31.
32.
高二年级化学试卷答案及点拨
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | D | C | BC | A | B、D | A、B | B | C | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C、D | B、D | B、D | B | A | B | A | D | D | C |
| 21 | 22 | 23 | 24 | 25 |
|
|
|
|
|
| A | A、C | C | A | D |
[思路点拨]
7.溶液中加入铝粉产生氢气,溶液中有酸(但不能是硝酸)或强碱.选项A、B均可为强碱溶液,符合题目可能存在的一种情况.选项C中HCO3-与H+或OH-均不共存.选项D中Mg2+与OH-不共存,H+、NO3-不能与Al反应产生H2,因此C、D均不符合题目条件.
8.PH均为3的醋酸和盐酸稀释相同倍数后醋酸的pH小于盐酸,对水的电离抑制更明显,因此醋酸中水电离的c(H+)更小.
9.①如果两种反应物,尽量增大一种反应物的浓度,另一反应物也不可全部转化为生成物,因此生成物的浓度只可能尽量超近于某一定值,但反应物总浓度可以任意增大,这种情况生成物百分含量降低.③有两种反应物,增大一种反应物浓度,另一反应物转化率增大,但该物质自身转化率降低.④对于气体参加的反应,如果加压向正向移动,所有气态物质(包括反应物)浓度均增大.⑥使用催化剂不影响平衡移动.
10.两溶液混合后为HCN和NaCN的混合液,二者浓度均为0.05mol/L.溶液中存在HCN的电离平衡和NaCN的水解平衡:
![]()
![]() HCN H++CN-,CN-+H2O HCN+OH-
HCN H++CN-,CN-+H2O HCN+OH-
已知溶液显碱性,推出CN-的水解比HCN的电离强,c(CN-)<0.05mol/L,c(HCN)>0.05mol/L,c(Na+)不变仍为0.05mol/L,选项A、B不正确.根据CN-与HCN转化守恒,可知c(HCN)+c(CN-)仍为0.05mol/L+0.05mol/L=0.1mol/L.
11.选项A不能用石蕊作滴定指示剂.选项B滴定管中装碱液不能用酸式滴定管.酸碱滴定时标准液可放在滴定管中也可放在锥形瓶中.C、D均正确.
13.选项C的离子方程式中已约去未反应的I-,生成物却是Fe3+,由于Fe3+与I-不共存可知该反应书写不正确.Fe3+与I-会反应生成Fe2+和I2.
14.如果将氨水换成NaOH,则Va=10Vb,pH均为11的氨水浓度比NaOH溶液大的多,因此Va<10Vb.
16.FeCl2溶液中有过量盐酸,加Zn(NO3)2后,NO3-与H+共同作用将Fe2+氧化.
20.铁还原性强于铜,先与稀硝酸反应.反应后剩余固体与盐酸反应无气体说明剩余固体为铜,推知溶液中无Fe3+(Cu与Fe3+反应),溶解的铁全部转化为Fe2+.
21.铝在浓硝酸中钝化,而铜可溶于浓硝酸,推知Cu为负极,电极反应式为Cu-2e-=Cu2+,电子由Cu沿导线流向Al.
![]() 22.已知平衡体系为:2NO2(g) N2O4(g),正反应放热.混合气体的平均相对分子质量46<M(混)<92,加入N2(M=28)会使混合气体平均相对分子质量减小.通入NO2.平衡会向正向移动,但NO2生成N2O4的转化率比原来增大.使
22.已知平衡体系为:2NO2(g) N2O4(g),正反应放热.混合气体的平均相对分子质量46<M(混)<92,加入N2(M=28)会使混合气体平均相对分子质量减小.通入NO2.平衡会向正向移动,但NO2生成N2O4的转化率比原来增大.使![]() 降低,平均相对分子质量增大.升温平衡逆向移动.NO2增多,N2O4减少,平均相对分子质量减小.通入N2O4,N2O4生成NO2的转化率比原平衡时降低,
降低,平均相对分子质量增大.升温平衡逆向移动.NO2增多,N2O4减少,平均相对分子质量减小.通入N2O4,N2O4生成NO2的转化率比原平衡时降低,![]() 增大,则平均相对分子质量增大.
增大,则平均相对分子质量增大.
23.设pH=1的盐酸为2L,平均分成两份,每份体积为1L.一份稀释后pH=2,可知体积为10L,加水9L.另一份加0.1mol/L NaOH溶液后pH也变为2.设NaOH溶液体积为V,则有:
0.1mol·L-1×1L-0.1mol·L-1V=0.01mol·L-1(1L+V)
24.从图中看出在溶液中滴加硫酸有沉淀生成,硫酸过量沉淀可溶解一部分.选项A中NaAlO2生成的沉淀Al(OH)3可溶于硫酸,Na2S2O3生成的沉淀S却不溶.选项B没有沉淀可溶.选项C无沉淀生成.选项D只生成沉淀S,不溶于硫酸.
25.设反应的Fe3+浓度为x
2Fe3++Cu=2Fe2++Cu2+
x x ![]()
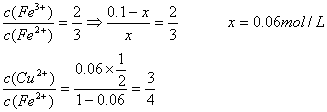
26.(1)④Mg(OH)2 ⑤NaAlO2 NaCl NaOH ⑦Al(OH)3
(2)Ⅱ.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
Ⅲ.NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3
27.(1)长
(2)不移动,向逆向
(3)增大,不变
![]() [思路点拨](1)2NO2 N2O4,容器中投入NO2,随反应进行,气体物质的量减小,A保持恒容,体积不变,B保持恒压,则体积减小,B对A而言,相当加压,速率加快,达平衡时间短.(2)平衡后通氩气,A中NO2、N2O4浓度不变,平衡不移动.B容器体积增大(对原平衡的NO2,N2O4相当减压),平衡向气体体积增大方向(逆向)移动.(3)平衡后向两容器通等量原气体,A中NO2,N2O4浓度同时同程度增大,(相当加压)平衡向正向移动.B容器体积相应增大,NO2、N2O4浓度保持不变,平衡不移动.本题的关键是A保持恒容,B保持恒压,改变条件分析NO2,N2O4浓度的变化.
[思路点拨](1)2NO2 N2O4,容器中投入NO2,随反应进行,气体物质的量减小,A保持恒容,体积不变,B保持恒压,则体积减小,B对A而言,相当加压,速率加快,达平衡时间短.(2)平衡后通氩气,A中NO2、N2O4浓度不变,平衡不移动.B容器体积增大(对原平衡的NO2,N2O4相当减压),平衡向气体体积增大方向(逆向)移动.(3)平衡后向两容器通等量原气体,A中NO2,N2O4浓度同时同程度增大,(相当加压)平衡向正向移动.B容器体积相应增大,NO2、N2O4浓度保持不变,平衡不移动.本题的关键是A保持恒容,B保持恒压,改变条件分析NO2,N2O4浓度的变化.
28.(1)H2、O2,负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
(2)负极:2H2-4e-=4H+,正极:O2+4H++4e-=2H2O
①小 ②大 ③负极CH4+10OH--8e-=CO32-+↑H2O
正极:2O2+4H2O+8e-=8OH-
[思路点拨]书写原电池的电极反应式先要正确书写反应式如氢氧燃料电池,总反应为2H2+O2=2H2O,还原剂H2发生氧化反应,该反应为负极反应式.氧化剂O2发生还原反应,该反应为正极反应式。在书写时注意酸碱介质条件,用OH-和H2O或H+和H2O去配平.由于两个电极反应式的加和为总反应,因此只要写对某电极反应式,用总反应减该电极式即得另一电极式.
(3)甲烧燃料电池的总反应为:
CH4+2O2=CO2+2H2O
CO2+2OH-=CO32-+H2O
以上两式的总反应为:CH4+2O2+2OH‑=CO32-+3H2O
正极反应比较好写,(与吸氧腐蚀的正极反应式相同)(+):2O2+4H2O+8e-=8OH-
总反应减正极反应即可得出负极反应式:
(-)CH4+10OH--8e-=CO32-+7H2O
29.(1)Fe2+,0.35mol;减少,2g
(2)Cu2+,0.1mol
[思路点拨](1)加入Fe,阳离子按氧化性从强到弱;Fe3+,Cu2+参加反应.Fe有剩余,则无Fe3+,Cu2+.2Fe3+ +Fe = 3Fe2+ Cu2 ++ Fe ===Cu + Fe2+
0.1mol→0.05mol 0.15mol 0.1mol→0.1mol 0.1mol 0.1mol
FeCl2不反应,则n(Fe2+)=0.15mol+0.1mol+0.1mol=0.35mol
消耗Fe0.15mol(8.4g),生成Cu0.1mol(6.4g),固体减轻2.0g.
(2)如果无固体存在说明Cu2+未参加反应,其物质的量仍为0.1mol,Fe3+可能部分反应或恰好完全反应,无法确定其量.
30.(1)200mL容量瓶,烧杯,玻璃棒,胶头滴管
(2)2-3,甲基橙(或酚酞),锥形瓶中溶液颜色变化,溶液由黄色变为橙色(或红
色变无色)
(3)①偏高 ②偏低 ③偏低
[思路点拨]选择指示剂要看中和后生成物的酸碱性Na2CO3与HCl反应后,由于溶液中有CO2会显弱酸性,因此应选择甲基橙(变色范围在酸性条件下)
分析误差时应先写出计算Na2CO3纯度的数学表达式,再行分析,设Na2CO3纯度为x
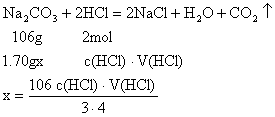
错误操作会引起V(HCl)数据不准.滴定终点时,滴定管悬着一滴标准酸,使V(HCl)读数偏大,x偏高.滴定中溶液局部变色,未滴到终点,V(HCl)偏小,x偏低,读数时先仰视后俯视使读数V(HCl)偏小,x偏低.
31.解:
![]()
![]()
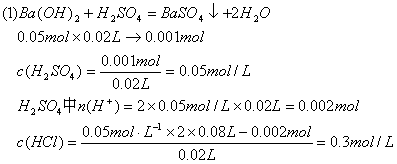
(2)B点时溶液中的酸还差50mLBa(OH)2才能恰好中和:50mLBa(OH)2中的OH-为0.05L×2×0.05mol/L=0.005mol未被中的![]()
pH=1
32.解:
加NaOH溶液溶解的沉淀为
Al(OH)3:![]()
加入金属生成的NaOH为:
2Na+2H2O=2NaOH+H2↑
2mol 22.4L
1.2mol 13.44L
使Al3+、Mg2+形成沉淀的NaOH为:
0.2mol×3+0.1mol×2=0.8mol
推知使Al3+转化为AlO2-的NaOH为1.2mol-0.8mol=0.4mol,生成AlO2-的Al3+为0.1mol