高二级化学单元目标检测题(理科) (C)
综合
满分100分,时间90分钟
可能用到的相对原子质量:H-1 Na-23 O-16 Cl- 35.5 N-14 S-32 C-12
第I卷 (选择题 共50分)
一、选择题(本题共25个小题,每小题只有一个选项符合题意,每小题2分,共50分)
1.
据报道,上海某医院在研究用放射性碘![]() 治疗肿瘤。该核素内的路子数为
治疗肿瘤。该核素内的路子数为
A.53 B. 125 C. 72 D.19
2. 下列物质互为同素异形体的一组是
A.C60和金刚石 B. ![]() 和
和![]()
C.正丁烷和异丁烷 D.乙烯和丙烯
3. 为了防止番茄在长途运输中发生腐烂,常常运输尚未完全成熟的果实,运到目的地后再用一种植物生长调节剂将其催熟。这种植物生长调节剂是下列物质中的
A.乙烷 B.乙烯 C.乙炔 D.乙醇
4. 下列呈酸性的盐溶液是
A.HCl溶液 B.Na2SO4溶液 C.NH4Cl溶液 D.Na2CO3溶液
5. 某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物对应的水化物的化学式为
A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4
6. 下列物质中,可以跟甲烷发生化学反应的是
A.氯气 B.稀盐酸 C.烧碱溶液 D.高锰酸钾溶液
7. 下列有机物的名称正确的是
A.2-乙基丁烷 B.2,3,3-三甲基丁烷
C.2,2,3-三甲基丁烷 D.1,3-二甲基丁烷
8. 下列各组离子,能在水溶液中大量共存的是
A.K+ SO42- HCO3- H+ B.NH4+ Cl- OH- Na+
C.CO32- Na+ K+ OH- D.Na+ Ag+ H+ I-
9. 下列说法正确的是
A.HNO3的摩尔质量为63g B.常温、常压下32gO2含有2NA个O
C.标准状况下,1molH2O的体积为22.4L
D.1L1mol/LCH3COONa溶液中c (CH3COO-)=1mol/L
10. 下列说法不正确的是
A.Na 、Mg 、Al金属性依次减弱 B.HF、HCl、HBr、HI的稳定性依次增强
C.H3PO4、H2SO4、HClO4的酸性依次增强 D.F2、Cl2、Br2、I2单质的氧化性依次增强
11. 下列反应的离子方程式正确的是
A. 碳酸钙和盐酸反应 CO32- +2H+ = CO2↑+H2O
B. 硝酸银溶液和稀盐酸反应 AgNO3 + Cl- = AgCl↓ + NO3-
C. 氯水滴入氯化亚铁溶液中 2Fe 2+ + Cl2 = 2Fe3+ + 2Cl-
D. 氢氧化铝和硫酸反应 H+ + OH- = H2O
12. 下列物质中属于弱电解质的是
A.冰醋酸 B.H2SO4溶液 C.BaSO4 D.Cl2
13. 可以跟水反应,且反应后溶液的PH小于7的是
A.Cl2 B.K C. NH3 D.SiO2
14. 目前没有列入“城市空气质量日报”报道项目中的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
15. 我国政府为了消除碘缺乏病,确保人体对碘的摄入量,一般是在食用盐中加入一定量的
A.I2 B.KIO3 C.AgI D.KI
16. 实验室进行下列实验时,必须在反应液中加入碎瓷片以防止暴沸的是
A.制溴苯 B.制硝基苯 C.制乙烯 D.制酚醛树脂
17. 实验室用Al2(SO4)3制取Al(OH)3,最合适的试剂是
A.NaOH B.H2SO4 C.NH3·H2O D.KOH
18. 决定化学反应速率的主要因素是
A.温度和压强 B.反应物的浓度 C.反应物的性质 D.催化剂的加入
19. 在通常状况下。不能大量共存的一组气体是
A.氧气和一氧化氮 B.氢气和氨气 C.氢气和氧气 D.甲烷和乙烯
20. 在通常状况下,下列物质中既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的液体是
A.乙烯 B.己烯 C.己烷 D.苯
21. 下列物质在光照条件下,不发生分解的是
A.HClO B.KCl C.AgBr D.HNO3
22. 漂白原理不是使有机色质氧化褪色的物质是
A.SO2 B.氯水 C.Na2O2 D.O3
23. 某烃完全燃烧生成CO2和H2O的质量比是44 :9,则该烃可能是
A.CH4 B. C2H6 C. C2H4 D.C6H6
24. 甲醛、乙醛、丙醛组成的混合物中,氢元素的质量分数为9%,则氧元素的质量分数为
A16% B.37% C.54% D.无法确定
25. C8H8在一定条件下受热裂化可生成CH4、C2H4、C2H6、C3H6、C4H8等五种物质的混合气体,则混合气体的平均相对分子质量为
A.22.8 B.38 C.57 D.114
第I卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
第II卷(非选择题 共50分)
二、填空题(本题9个小题,共26分)
26. (4分)配平化学方程式:
. K2S + HNO3 = KNO3 + S↓+ NO↑+ H2O
氧化剂是 ,还原剂是 。
27. (3分)含酒精99.5%以上的酒精称作 ,当制作这种酒精时,通常需要把工业酒精跟新制的 混合,再进行 才能得到。
28. (1分)当人误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒。重金属盐使人中毒的原因是 。
29.
(2分)在一定条件下,达到化学平衡的可逆反应:N2+3H2![]() 2NH3(正反应为放热反应),如果只增大压强,其它条件不变,则平衡向 方向移动(填正反应或逆反应);如果只升高温度,平衡向 方向移动(填正反应或逆反应)。
2NH3(正反应为放热反应),如果只增大压强,其它条件不变,则平衡向 方向移动(填正反应或逆反应);如果只升高温度,平衡向 方向移动(填正反应或逆反应)。
30. (3分)A元素原子M电子层上有6个电子。B元素与A元素位于同一周期,最外层只有1个电子。
(1)写出A元素原子核外各电子层上的电子数 。
(2)A、B两元素形成的化合物是 ,该化合物在无色灯焰上灼烧时,使火焰呈 色。
31.
(3分)已知羟基与烯烃双键碳原子相连接时,易发生如下变化: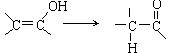 ,现有下列转化关系:
,现有下列转化关系: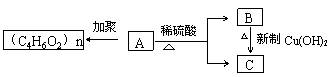
(1)写出A的结构简式 。
(2)写出B→C的化学方程式 。
32. (4分)根据下列各有机物回答问题(用编号填写)
①
C2H2 ②![]() ③CH3CHO ④ C2H4 ⑤
③CH3CHO ④ C2H4 ⑤![]() ⑥CH3COOH
⑥CH3COOH
(1) 属于芳香烃的是 。
(2) 能跟FeCl3溶液作用显示紫色的是 。
(3) 能跟Na2CO3反应放出气体的是 。
(4) 能发生银镜反应的是 。
33. (2分)铁制吕在电镀前可以用盐酸清除表面的铁锈(铁锈主要成分是Fe2O3),此反应的化学方程式为 。若此反应生成物的溶液与除锈后的铁接触,其反应的离子方程式是 。
34. (4分)A、B、C、D四种可溶性盐,它们的阳离子可能是Ba2+、 Ag+、 Na+、 Cu2+中的某一种,阴离子可能是NO3- SO4- Cl- SO32-中的某一种(阴、阳离子都不重复使用)
(1) 若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2) 若将(1)的四支试管中分别加入盐酸,B盐溶液有沉淀产生,D盐溶液有刺激性气体产生,则根据(1)(2)实验事实可推断它们的化学式为A ,B ,C ,D 。
三、简答题(本题共3个小题,共14分)
35. (4分)进行化学实验必须注意安全,下列说法正确的是 。
A.
 如果苯酚深溶液沾到皮肤上,应立即用酒精洗涤
如果苯酚深溶液沾到皮肤上,应立即用酒精洗涤
B. 在点燃H2、CH4等易燃气体前,必须检验气体的纯度
C. 实验室制取己烯时,直接加热烧瓶使液体温度迅速上升到170℃
D. 不慎将浓硫酸沾到皮肤上,要立即用大量水冲洗
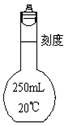
36. (6分)欲配制250mL0.1mol/L 的NaOH溶液,回答下列有关问题:
(1)写出右图仪器的名称 ,使用此仪器前要检查它是否 。
 (2)转移溶液时,就将已冷却的NaOH溶液沿 注入右图所示的仪器中。
(2)转移溶液时,就将已冷却的NaOH溶液沿 注入右图所示的仪器中。
(3)若称量前NaOH已部分潮解,则配制的溶液的浓度 (填偏大或偏小)。
37. (4分)酚醛树脂是1907年世界上第一种合成的高分子材料。右图是实验室制取酚醛树脂的装置图:
(1)胶塞上玻璃管的作用是 。
(2)制取酚醛树脂的化学方程式是 。
(3)制备完毕,试管上留少量生成物,可加入 ,浸泡几分钟,然后清洗。
四、计算题(本题2个小题,共10分)
38. (4分)充满NO和NO2混合气体的试管倒立在水中,充分反应后,水进入试管达到试管的1/2高度,原混合物气体中NO2的体积分数是多少?
39. (6分)将一定量的Na2CO3和NaHCO3的混合物加热,充分反应至固体质量不再减少,生成CO2气体体积为2.24L,反应后的固体残渣与100mL盐酸恰好完全反应,又生成CO2气体4.48L(气体体积均在同温同压下测定)。试求:
(1) 原混合物中Na2CO3和NaHCO3的物质的量各是多少?
(2) 所用盐酸溶液的物质的量浓度。
综合C 答案
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | A | B | C | D | A | C | C | B | D | C | A | A |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | C | B | C | C | C | A | B | B | A | D | B | B |
二、
26. 3、8;6、3、2、4 HNO3 K2S
27.无水酒精、新制生石灰、蒸馏
28.重金属盐类使蛋白质变性
29正反应 逆反应
30.(1)2,,8,6 .(2)Na2S ,黄色
31.CH3COOCH=CH2 CH3CHO + 2 Cu(OH)2 = CH3COOH + Cu2O↓ + 2H2O
32.(1)② (2)⑤ (3)⑥ (4)③
33.Fe2O3 + 6HCl = 2FeCl3 + 3H2O 2Fe3+ + Fe = 3 Fe2+
34.A. BaCl2 B.AgNO3 C. CuSO4 D.Na2SO3
35.A、B
36.(1)容量瓶 是否漏水 (2)玻璃棒 (3)偏小
37. (1)冷凝 回流 (2)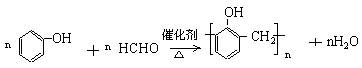
(3) 精
四、
38.60%
39. (1)NaHCO3的物质的量为0.2mol Na2CO3的物质的量为0.1mol
(2)C (HCl) = 4mol/L