高二级化学科第一学期期中考试试卷
(共6页)
班级 姓名 考号 _座号
可能用到原子量:H 1 C 12 O 16 Si 28 Al 27 Mg 24
Na23 Zn 65 Cu 64 Fe 56 Cl 35.5 N 14
第Ⅰ卷
一、 选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
⒈下列关于镁的性质的叙述,错误的是( )
A.能在CO2中燃烧 B.能在空气中燃烧,放出大量热
C.能与碱溶液反应、放出氢气 D.硬度、密度都比铝小
⒉下列液体中加入肥皂水后振荡、不产生沉淀并有较多泡沫的是( )
A.海水 B.食盐水 C.光卤石浸出液 D.流经石灰岩的水
⒊下列各组物质中,晶体类型不同,且前者熔沸点高于后者的是
A.NaCl、金刚石 B.SiH4、CH4
C.SiO2、CO2 D.H2S、H2O
⒋制取下列物质,不直接用石灰石的是( )
A.玻璃 B.生石灰 C.水泥 D.硫酸
⒌学名、俗名(含溶液)、用途不相匹配的是( )
A.硅酸钠、水玻璃、建筑粘接剂
B.碳酸氢钠、苏打、制玻璃
C.二水硫酸钙、石膏、调节水泥凝结时间
D.硫酸铝钾、明矾、净水剂
⒍某硬水中无Ca2+ ,只有Mg2+,若用石灰、纯碱将Mg2+转化为Mg(OH)2↓,Ca2+转化为CaCO3↓,从而达到软化硬水的目的,所加试剂的物质的量的关系最好是( )
A.石灰用量>纯碱用量 B.石灰用量<纯碱用量
C.石灰用量=纯碱用量 D.无法判断
⒎某无色透明溶液能与铝作用放出氢气,此溶液中能大量共存的离子是( )
A.OH-、NO3-、Ba2+、Cl- B.H+、Ba2+ 、Mg2+、NO3-
C.Cu2+、H+、Al3+、SO42- D.Na+、K+、MnO4-、Cl-
⒏能用铝制容器盛装的有( )
A.硫酸铜溶液 B.浓烧碱溶液
C.Na2SiO3溶液 D.69%的硝酸
⒐用生铁冶炼成碳素钢的主要目的是( )
A.用还原剂把氧化亚铁还原成铁
B.适当降低铁里的含碳量、调整钢里合金元素含量,除去大部分硫磷等有害杂质
C.加入各种合金元素,改善铁的性能
D.把生铁提纯,除去生铁中的各种杂质
⒑由Na、Mg、Zn、Al四种金属单质中的两种组成的混合物共12g,跟足量盐酸反应,产生5.6L氢气(标准状况),由此判断混合物中必含有( )
A.Mg B.Al C.Zn D.Na
⒒取一定量的镁—铝合金,用足量盐酸溶解后,再加入过量NaOH溶液然后滤出沉淀物,加热灼烧,最后得到白色粉末,干燥后称量,这些粉末与原合金质量相等,则合金中铝的百分含量为( )
A.40% B.58.6% C.60% D.20%
⒓下列各组中的两种物质,即使按恰当的比例混合仍不能符合下列①至③各条 要求的是( )
① 加过量水形成透明溶液且有气体放出
② 加过量盐酸形成透明溶液且有气体放出
③ 加过量NaOH溶液形成透明溶液且有气体放出
A.Na2O2和Al2O3 B.Mg3N2和SO3
C.P2O3和NH4HCO3 D.Na2O和Al
⒔在100亳升0.1mol/L CuSO4溶液中放入m克薄铁片,反应片刻后将铁片取出 洗净,干燥后称量为(m+0.08克),此时溶液仍为100亳升,则其中Fe2+物质的量浓度为( )
A.1×10-4mol/L B.1×10-3mol/L
C.1×10-2mol/L D.0.1mol/L
⒕ a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:⑴ a、 c 均能与稀H2SO4反应放出气体;⑵ b与d的硝酸盐反应,置换出单质d;⑶ c 与强碱反应放出气体;⑷ c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
⒖某结晶水合物化学式为A·xH2O,其式量为B,在60℃时,mg晶体完全溶于ng水中,制得饱和溶液VmL,下列表达式中正确的是( )
A.该饱和溶液中溶质的质量分数为![]()
B.该饱和溶液中溶质的量浓度为![]()
C.60℃时A的溶解度为![]()
D.该饱和溶液VmL中含溶质mg
⒗ 500mL 1mol/L FeCl3溶液,加入铁粉至还原完全,除去多余铁粉后加足量 NaOH溶液,所得沉淀的物质的量为( )
A.0.5mol B.1mol C.0.75mol D.不能确定
⒘下列物质不属于混合物的是( )
A.铝热剂 B.水泥 C.水玻璃 D.明矾
⒙在下列各组物质中,同一种元素的化合价相同的是( )
A.AlCl3和NaAlO2 B.SiH4和SiO2
C.Fe2O3和FeCl2 D.Mg和Mg(OH)2
⒚下列说法正确的是( )
A.硅的晶体与水晶都属于晶体 B.原硅酸是挥发性酸
C.铝单质广泛存在于自然界中 D.石英和干冰的组成和结构相似
⒛下列物质的晶体熔点最高的是( )
A.二氧化碳 B.二氧化硅 C.铝镁合金 D.硫
21.在地壳中能以游离态存在的元素是( )
A.硅 B.碳 C.铁 D.镁
22.下列元素的最高价氧化物的水化物碱性最弱的是( )
A.Na B.Mg C.Al D.Ca
23.下列盛放试剂的方法中,正确的是( )
A.把水玻璃盛放在带玻璃塞的试剂瓶里
B.把氢氧化钠溶液盛放在带玻璃塞的试剂瓶里
C.把氢氟酸盛放在玻璃试剂瓶里
D.把氢氧化钾溶液盛放在带橡皮塞的试剂瓶里
24.下列各种变化中,不能通过一步反应就能实现的是( )
A.Al2O3 → AlCl3 B.SiO2 → H4SiO4
C.MgO → Mg(OH)2 D.MgCl2 → Mg
25.下列图中,能表示将氢氧化钡溶液逐滴加入到硫酸铝溶液中,产生沉淀的质量Wg与加入氢氧化钡溶液的体积VmL关系的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]() W
W
W
W
W
W
W
W
 |  | ||||||
 | |||||||
![]() V
V
V
V
V
V
V
V
A. B. C. D.
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且正确的给2分,但只要选错一个该小题就为0分)
26.CO和O2的混合气100毫升,在一定条件下使其充分反应并恢复到原状况,体积变为88毫升,原混合气体中CO和O2的体积比为( )
A.88:12 B.12:88 C.50:50 D.24:76
27.下列各组离子加入足量氨水后,现象有明显不同的是( )
①Fe3+、Fe2+ ② Ag+、Al3+ ③ Na+、Ba2+
④ Mg2+ 、Al3+ ⑤ Fe3+、 Al3+ ⑥ Mg2+、Fe2+
A.①②④⑤ B.①②④⑥ C.①②⑤⑥ D.①④⑤⑥
28.已知:Zn+2Fe3+=Zn2++2Fe2+现将CuSO4、FeCl3和Zn置于水中,充分反应
后,反应器中,所得混和物除SO42-和Cl-外还含有( )
A.Cu、Zn2+、Fe2+ B.Zn2+、Cu2+、Fe2+
C.Zn2+、Cu2+、Fe 、Fe2+ D.Zn2+、Cu2+、Cu、Fe2+
29.向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式
是( )
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2-形式存在于溶液中
30.下列离子方程式不正确的是( )
A.Ca(HCO3)2溶液中加入过量NaOH溶液:
Ca(HCO3)2+OH-=CaCO3↓+H2O
B.H2S通入Pb(NO3)2溶液: Pb2++H2S=PbS↓+2H+
C.偏铝酸钠溶液和过量盐酸反应 : AlO2-+4H+=Al3++2H2O
D.明矾溶液中加入适量的Ba(OH)2溶液: Ba2++SO42-=BaSO4↓
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | B | C | D | B | C | A | D | B | C | A | B | D | C | C |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | C | D | A | A | B | B | C | D | B | D | D | C | AD | D | AD |
第Ⅱ卷
三、 填空题 (本题包括3小题,共14分)
31.(6分)石英粉跟纯碱混和后在高温下反应,生成的固体物质的化学式是 Na2SiO3 ,它溶于水成为粘稠状物质,俗名叫 水玻璃 ,这种物质与盐酸反应生成一种叫做 原硅酸 的 白 色 胶 状沉淀,它的组成通常用 H4SiO4 表示。
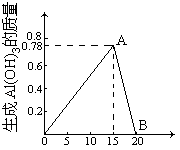 32.(4分) 向20mL某未知浓度的AlCl3溶液中滴入2mol/L的NaOH溶液时,所得到Al(OH)3的质量与所滴入的NaOH溶液的体积之间的关系如图所示,图中A点所表示的意义是 当加入NaOH溶液为15mL时,生成的Al(OH)3沉淀最多,为0.78g ;B点表示的意义 当加入NaOH溶液为20mL时,生成的Al(OH)3沉淀又完全溶解 ; NaOH V(毫升)溶液的物质的量浓度是 0.5 mol/L。当加入NaOH溶液的体积为10mL时,可得Al(OH)3沉淀为 0.52 g。
32.(4分) 向20mL某未知浓度的AlCl3溶液中滴入2mol/L的NaOH溶液时,所得到Al(OH)3的质量与所滴入的NaOH溶液的体积之间的关系如图所示,图中A点所表示的意义是 当加入NaOH溶液为15mL时,生成的Al(OH)3沉淀最多,为0.78g ;B点表示的意义 当加入NaOH溶液为20mL时,生成的Al(OH)3沉淀又完全溶解 ; NaOH V(毫升)溶液的物质的量浓度是 0.5 mol/L。当加入NaOH溶液的体积为10mL时,可得Al(OH)3沉淀为 0.52 g。
33.(4分)写出下列有关的化学反应方程式:
⑴用铝热法制取金属铬的反应: Cr2O3 + 2Al 点燃 Al2O3 + 2Cr 。
⑵用磺化煤除去硬水中的钙离子反应: 2NaR + Ca2+ CaR2 + 2Na+ 。
四、(本题包括3小题,共21分)
34.(4分)自然界的矿物胆矾(CuSO4·5H2O)溶于水后若遇到黄铁矿(FeS2),就会发生反应,生成辉铜矿(Cu2S),硫酸亚铁和硫酸。在有些矿区见到的具有强酸性,强腐蚀性的地下水,俗称:“黑水”,就是经过这种反应产生的。请写出上述反应的化学方程式: CuSO4+5FeS2+12H2O == 7Cu2S+5FeSO4+12H2SO4 。反就中被氧化的硫原子与被还原的硫原子的物质的量之比为 3:7 。
35. (3分)从海水中提取金属镁的步骤有:①浓缩结晶 ②加熟石灰 ③加盐酸 ④过滤 ⑤溶融电解,正确的生产步骤是 ②④③①⑤ 。
36. (14分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验步骤:
⑴ 称取样品a克(该实验使用仪器名称 天平 )。
⑵ 将样品溶解于足量稀盐酸中,过滤、滤液中主要含有的物质是 MgCl2、AlCl3 ,滤渣中主要含有的物质是 Cu、Si ,该溶解,过滤实验中使用的仪器有 烧杯,玻璃棒,漏斗,铁架台(带铁圈) 。
⑶ 向滤液中加入过量的NaOH溶液,过滤,写出有关反应离子方程式:
Mg2++2OH- == Mg(OH)2↓、 Al3++3OH- == Al(OH)3↓、 Al(OH)3+OH-==AlO2-+3H2O 。
⑷ 上述滤液中通入足量的CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至的质量不再减少为止,冷却后称得质量为bg。有关反应方程式为:
NaAlO2+H2O+CO2==Al(OH)3↓+NaHCO3 、
2Al(OH)3 △ Al2O3+3H2O 。
该样品中的铝的质量分数为
![]() 。
。
⑸ 若实验⑶中NaOH量不足,则测定结果偏 低 (高、低、不影响);若实验中沉淀没有洗涤,则测定结果偏 高 。
五、计算题(本题包括2小题,共15分)
37.(6分)各含0.1摩尔AlCl3的溶液两份,分别加入等物质的量的浓度NaOH溶液,第一份过量,第二份过量,反应完毕后,两份溶液中都有3.9克沉淀。则第一份溶液与第二份溶液所加氢氧化钠溶液的体积比是多少?

所以NaOH过量时,要使0.1molAlCl3产生3.9g沉淀需NaOH(0.3+0.05)mol.
由于两组实验中所用NaOH溶液的物质的量浓度相等,故溶液的体积比等于它们的物质的量的比.即
0.15:0.35=3:7
答:(略)
38.(9分)对化学式为FeSO4·m(NH4)2SO4·nH2O的复盐A进行如下实验:
⑴ 取4.8gA与浓烧碱溶液共热,用50mL 0.5mol/L的硫酸吸收产生的气体,过量硫酸用1mol/L的NaOH溶液25.5mL可完全中和。
⑵取7.84gA配成水溶液,向其中加入2mol/L的BaCl2溶液20mL恰好使SO42-全部沉淀,依据上述实验计算;
① A盐中NH4+和SO42-离子的质量分数;
② A化学式中m和n值。

