高二级化学科第一学期期终教学质量检测
试题卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分。考试时间为90分钟。
注意: ⒈将各题答案填在答题卷相应位置上。
⒉可能用到的相对原子质量:
H 1 O 16 C 12 N 14 Na 23 Cl 35.5
第Ⅰ卷(选择题,共54分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意。)
⒈本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是( )
A. 化学反应速率理论是研究怎样在一定时间内快出产品
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学反应速率理论是研究怎样提高原料转化率
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
⒉下列说法中,可以说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 1个![]() 键断裂的同时,有1个H-H键形成
键断裂的同时,有1个H-H键形成
B. 1个![]() 键断裂的同时,有3个H-H键断裂
键断裂的同时,有3个H-H键断裂
C. 1个![]() 键断裂的同时,有6个H-H键断裂
键断裂的同时,有6个H-H键断裂
D. 1个![]() 键断裂的同时,有3个H-H键形成
键断裂的同时,有3个H-H键形成
⒊已知 ⑴ H2(g) + ![]() O2(g) =
H2O(g) △H1 = a kJ/mol
O2(g) =
H2O(g) △H1 = a kJ/mol
⑵ 2H2(g) + O2(g) = 2H2O(g) △H2 = b kJ/mol
⑶ H2(g)
+ ![]() O2(g) =
H2O(l) △H3 = c kJ/mol
O2(g) =
H2O(l) △H3 = c kJ/mol
⑷ 2H2(g) + O2(g) = 2H2O(l) △H4 = d kJ/mol
下列关系式中正确的是( )
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
⒋在 A(g) + p B(g) ![]() q C(g) 的反应中,经t秒后C的浓度增加m mol/L,则用B浓度的变化来表示的反应速率是( )
q C(g) 的反应中,经t秒后C的浓度增加m mol/L,则用B浓度的变化来表示的反应速率是( )
A. ![]() mol·L-1·s-1 B.
mol·L-1·s-1 B.
![]() mol·L-1·s-1
mol·L-1·s-1
C. ![]() mol·L-1·s-1 D.
mol·L-1·s-1 D.
![]() mol·L-1·s-1
mol·L-1·s-1
⒌某温度下,在一容积可变的密闭容器中,反应2A(g) + B(g) ![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半 B. 均加倍 C. 均增加1mol D. 均减少1mol
⒍右图所示为800℃时A、B、C三种气体在密闭容器中反
 应时浓度的变化。只从图上分析不能得出的结论是( )
应时浓度的变化。只从图上分析不能得出的结论是( )
A. A是反应物
B. 前2 min A的分解速率为0.1mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 达平衡后,若增大压强,平衡向逆反应方向移动
⒎在一密闭容器中,等物质的量的A和B发生如下反应: A(g) + 2B(g) ![]() 2C(g);一段时间后,反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是( )
2C(g);一段时间后,反应达到平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率是( )
A. 40% B. 50% C. 60% D. 70%
⒏A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气时消耗这三种醇的物质的量之比为2∶6∶3,则这三种醇中羟基数之比为( )
A. 3∶2∶1 B. 3∶1∶2 C. 2∶1∶3 D. 2∶6∶3
二、选择题(本题包括7小题,每小题4分,共28分,每小题有一或二个选项符合题意。)
⒐下列事实不能用勒夏特列原理解释的是( )
A. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B. 黄绿色的氯水光照后颜色变浅
C. 使用催化剂可加快SO2转化为SO3的速率
D. 含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,颜色变浅或褪去。
⒑某有机物的分子式为C5H10O,它能发生银镜反应和加成反应,若将它们与H2加成,所得产物的结构简式可能是( )
A. ![]() B.
(CH3CH2)2CHOH
B.
(CH3CH2)2CHOH
C. CH3(CH2)3CH2OH D. (CH3)2CHCH2CH2OH
⒒在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应:2A(g)+B(g) ![]() 3C(g) +D(s),达到平衡时C的浓度为1.2mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2mol/L的是( )
3C(g) +D(s),达到平衡时C的浓度为1.2mol/L。若维持容器体积和温度不变,按下列方法改变起始物质,达到平衡时C的浓度仍可能为1.2mol/L的是( )
A. 4 mol A + 2 mol B
B. 3 mol C + 1 mol D + 1mol B
C. 3 mol C + 0.8 mol D
D. 1.6 mol A + 0.8 mol B + 0.6mol C + 0.3mol D
⒓下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
① C(s) + O2(g)
= CO2(g); C(s)
+ ![]() O2(g) =
CO (g);
O2(g) =
CO (g);
② S(s) + O2(g) = SO2(g); S(g) + O2(g) = SO2 (g);
③ H2(g) + ![]() O2(g) = H2O (g); 2H2(g)
+ O2(g)
= 2H2O
(l);
O2(g) = H2O (g); 2H2(g)
+ O2(g)
= 2H2O
(l);
④ CaCO3(s)= CO2(g) + CaO(s); CaO(s) + H2O (l) = Ca(OH)2 (s);
A. ① B. ③④ C. ②③④ D. ①②③
⒔莽草酸(结构简式为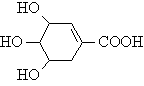 )是一种抗禽流感病毒的成分,下列关于莽草酸的说法,正确的是( )
)是一种抗禽流感病毒的成分,下列关于莽草酸的说法,正确的是( )
A. 遇FeCl3溶液呈紫色 B. 能与Br2发生加成反应
C. 能发生酯化反应 D. 能与Br2发生取代反应生成白色沉淀
⒕某温度下,密闭容器中发生反应 a X (g) ![]() b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
A. 可逆反应的化学计量数:a>b+c
B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小
D. 达到新平衡时,混合物中Z的质量分数增大
⒖1-溴丙烷和2-溴丙烷分别与NaOH乙醇溶液共热的反应( )
A. 产物相同 B. 产物不同
C. 碳氢键断裂的位置相同 D. 碳氢键断裂的位置不同
第Ⅱ卷(非选择题,共46分)
⒗(每空2分,共12分。)
某化学反应 2A(g) ![]() B(g) +D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度随反应时间的变化情况如下表:
B(g) +D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度随反应时间的变化情况如下表:
| 实验 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:(实验序号1以⑴代表,余同。)
①在⑴中,反应在10至20 min 内平均速率υ 为 mol·L-1·min-1;
②在⑵中,A的初始浓度c2 = mol·L-1。
③设⑶的反应速率为υ3,⑴的反应速率为υ1,则υ3 υ1(填>、=、<)且c3 1.0 mol·L-1(填>、=、<)。
④比较⑷和⑴,可推测该反应是 反应(选填“吸热”、“放热”)。理由是
。
⒘(每空2分,共4分。)
⑴发射“神州六号”载人飞船的长征火箭是用肼(N2H4)燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g) + 2O2(g) = 2NO2(g) △H=67.7 kJ·mol-1;
N2H4(g) + O2(g) = N2(g) + 2H2O (g) △H=-534 kJ·mol-1;
肼与二氧化氮反应的热化学方程式为 。
⑵已知下列反应:
H2(g) = 2H(g) △H1=+Q1 kJ·mol-1;
O2(g) = 2O(g) △H2=+Q2 kJ·mol-1;
2H(g) +O(g) = H2O (g) △H3=-Q3 kJ·mol-1;
H2O (g) = H2O (l) △H4=-Q4 kJ·mol-1;
H2(g)
+ ![]() O2(g) = H2O (l) △H5=-Q5 kJ·mol-1;
O2(g) = H2O (l) △H5=-Q5 kJ·mol-1;
试指出Q1、Q2、Q3、Q4、Q5的等量关系: 。
⒙(每空2分,共6分。)
⑴设计实验证明溴乙烷在NaOH水溶液中发生取代反应(即溴乙烷里的Br变成了Br―)
。
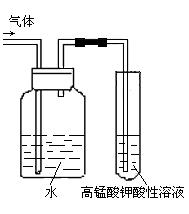 ⑵将溴乙烷与NaOH乙醇溶液的反应生成的气体进行
⑵将溴乙烷与NaOH乙醇溶液的反应生成的气体进行
检验。有人设计了如图实验方案。请回答:
气体通入KMnO4酸性溶液前加一个盛有水的洗气瓶,
其中洗气瓶中水的作用是 ,
其原因是
。
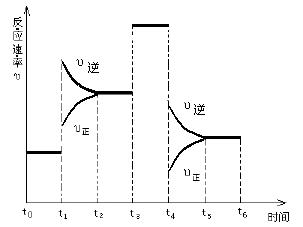 ⒚(每空2分,共10分。)
⒚(每空2分,共10分。)
一密闭容器中发生下列反应
N2+3H2![]() 2NH3;△H<0,
2NH3;△H<0,
右图是某一时间段中反应速率与
反应进程的曲线关系图。回答:
⑴处于平衡状态的时间段是 。
⑵t1、t3、t4时刻,体系中分别是什么条件发生了什么变化?
、
、
。
⑶下列时间段中,氨的百分含量最高的是
A. t0~t1 B. t2~t3 C. t3~t4 D. t5~t6
⒛(每空2分,共16分。)
A是一种可以作为药物的有机物。请根据下图所示的转化关系,回答问题
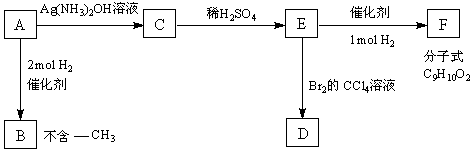
⑴写出A、B、F的结构简式:A B F
⑵写出下列变化的化学方程式,并注明反应类型。
A → C
反应类型
E → D
反应类型
⑶B的一种同分异构体只含一个-CH3,且1mol该物质能与浓Br2水反应,共消耗3mol Br2。则该有机物的结构简式为 。
第一学期期终教学质量检测
高二级化学科答题卷
高二级 班 座号 姓名 成绩
一、二选择题(共52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 |
⒗(每空2分,共12分。)
① mol·L-1·min-1; ② mol·L-1
③υ3 υ1 c3 1.0 mol·L-1
④ 反应 理由是
。
⒘(每空2分,共4分。)
⑴
⑵
⒙(每空2分,共6分。)
⑴
。
⑵作用是 ,
原因是 。
⒚(每空2分,共10分。)
⑴时间段 。
⑵t1 、
t3 、
t4 。
⑶
⒛(每空2分,共16分)
⑴A B F
⑵A → C
反应类型
E → D
反应类型
⑶结构简式为 。
