高二级理科化学试卷
考试时间:90分钟 总分:100分
姓名 学号: 成绩:
可能用到的相对原子质量:H-1 N-14 O-16 Cl-35.5 Ca-40 Mn-55 Cu-64 S-32 K-39
一、选择题:(本题共20个小题,每小题3分,共60分。每题只有一个正确答案,请将答案填入后面的答题卡内。)
1、下列各组气态氢化物中,按稳定性顺序排列正确的是( )
A. SiH4> PH3>H2S>HCl B.HF>HCl>HBr>HI
C. NH3>PH3>AsH3>HF D.PH3>AsH3> H2S>HCl
2、下列物质不能在空气中长期存在的是( )
A.N2 B.NO C.红磷 D.NH3
3、下列对砷及其化合物性质的推测正确的是:( )
A.砷的最高化合价为+5 B.砷酸的酸性比硝酸强
C.砷的非金属性比磷强 D.砷的氢化物比磷的氢化物稳定
4、下列属于同素异形体的是( )
A.11H和21H B.H+和H C.H2O和H2O2 D.白磷和红磷
5、下列物质中不能用于干燥氨气的是( )
A.浓硫酸 B.固体氢氧化钠 C.碱石灰 D.生石灰
6、常温下,能被浓硝酸溶解的金属是( )
A.Al B.Ag C.Fe D.Au
7、下列变化中不属于氮的固定的是( )
A.豆科植物的根瘤菌把氮气变为NH3
B.工业上将NH3与CO2在高温高压下制成[CO(NH2)2]
C.工业上用N2和H2合成NH3
D.闪电时,空气中的O2 和N2化合成NO
8、含磷洗涤剂是城市生活污水中污染物的重要来源之一,它是导致水体富营养化、水质变坏的重要原因之一。重庆地处三峡库区,为防止水体的磷污染,可行的措施是( )
A. 立即停止生产、销售和使用含磷洗涤剂
B. 尽快建设若干大型城市生活污水处理厂
C. 尽快开发并推广应用无磷、无污染的洗涤剂
D. 大大提高含磷洗涤剂的价格,尽可能降低其消费量
9、下列固体混合物中,能通过加热使它们分离的是:
A.NH4Cl、I2 B.KCl、NaOH
C.KClO3、MnO2 D.NH4Cl、Na2SO4
10、在盐酸和KNO3的溶液中能大量共存的是( )
A.Fe2+ B.CO32- C .S2- D.SO42-
11、下列反应的离子方程式正确的是:
A.Cu和稀硝酸 Cu+4H++NO3-=Cu2++NO↑+2H2O
B.Na和FeCl2溶液 2Na+Fe2+=2Na++Fe
C.NO2通入水中 3NO2+H2O=2H++2NO3-+NO
D.Cl2通入水中 Cl2+H2O=2H++Cl-+ClO-
12、下列气体的制取中,与氨气的实验室制取装置相同的是:
A.Cl2 B.O2 C.H2 D.CO2
13、下列变化需加入氧化剂方能实现的是( )
A.Cl-→Cl2 B.NaCl→HCl C.HNO3→NO D.SO2→SO32-
14、氢叠氮酸HN3与HCl相似,它是易挥发的弱酸。下列叙述中不正确的是( )
A.它的水溶液中存在N3- B.是无色、有刺激性气味的气体
C.NaN3与稀硫酸作用生成NH3 D.它与NH3作用生成的是共价化合物
15、现有化学方程式aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若a=3,b=3,X为还原产物,其化学式为( )
A.NO2 B.NO C.N2O D.NH4Cl
16、在3S+6KOH=2K2S+K2SO3+3H2O的反应中,被氧化的硫与被还原的硫的质量比是:( )
A.3:1 B.3:2 C.1:2 D.2:1
17、6.4g铜与足量的浓硝酸反应,铜全部反应完后,共收集到气体2.24L(标准状况),反应中消耗硝酸的物质的量和被还原的硝酸的物质的量分别为( )
A.0.5mol, 0.1mol B.0.3mol, 0.1mol
C.0.4mol, 0.2mol D.无法确定
18、相同状态下,将下列四种等体积混合气体:①体积比3:1的NH3和N2;②体积比为1:1的NO2和NO;③体积比1:1的NO2和O2;④体积比4:3的NO和O2。分别置于完全相同的试管中,并倒置于水槽中,充分反应后液面上升的高度分别为h1,h2,h3,h4,则下列关系正确的是( )
A. h1>h2>h3>h4 B. h4>h2>h3> h1 C. h4>h1>h3 >h2 D. h2>h3>h1>h4
19、含有下列物质的硫酸铵,经测定含氮为20.16%,则硫酸铵中必定混有( )
A.NH4NO3 B.NH4HCO3 C. CO(NH2)2 D.NH4Cl
20、将8g硫在16g氧气中充分燃烧后,所得气体在标准状况下的总体积是( )
A.22.4L B.5.6L C.11.2L D.15L
姓名 学号: 成绩:
一、选择题答题卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
二、填空题(本题包括4小题,共计18分)
21、氮族元素位于 族,主要包括 , , , , (用元素符号填写)。
22、实验室里的浓硝酸放置一段时间后变黄了,其原因是
而工业上的浓盐酸也呈黄色,这是因含 引起的。
23、配平并回答有关问题:
□CuS+□HNO3△=□Cu(NO3)2+□H2SO4+□NO↑+□H2O
若有0.15molCuS参加反应,则被还原得硝酸是______mol,未被还原的硝酸是_______mol。
24、有一无色混合气体,可能由CO2、HCl、NH3、O2、NO2、NO中的几种组成,经以下实验:(4分)
(1)混合气体通过浓硫酸时,气体体积明显减少,
(2)再通过碱石灰,气体体积又明显减少,
(3)剩余气体与空气接触时,立即变成红棕色。
则原混合气体中,一定有__________________________,一定没有_________________
三、实验题:(12分)
25、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
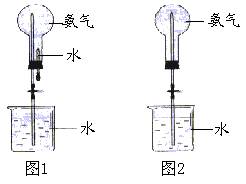
(1) 出实验室制取氨气的化学方程式:
。
(2) 收集氨气应使用 法,要得到干燥的氨气可选用 干燥剂。
(3) 如何检验烧瓶内的氨气已经收集满?
。
(4) 用图1装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是 该实验的原理是 。
(5) 一般做喷泉实验水都不可能将烧瓶充满,其主要原因是
(6) 如果只提供如图2的装置,请说明引发喷泉的方法:
。
四、计算题:(10分)
26、将3.84g铜与足量的稀硝酸充分反应,可收集到标准状态下的气体多少升?(4分)
27、工业上用氨作原料制硝酸。若由氨催化氧化制得NO的产率为96%,由NO制得的硝酸的转化率为90%,问生产200吨63%的硝酸需要氨气多少吨?