高二镁、铝单元测试题
姓名 班级 得分
注意:本卷满分100分,考试时间120分钟。
可能用到的原子量:Mg-24 Al-27 Na-23 O-16 C-12 Cu-64 Fe-56 Zn-65 Cl-35.5
一、选择题(每小题3分,共48分。每小题有1~2个选项符合题意)。
1. 有关金属性质的叙述正确的是:
A、常温下都是晶体。 B、最外层电子数少于3个的都是金属。
C、不论呈任何状态都有延展性。 D、都能导电、传热。
2. 下列金属中熔点最低的是:
A、钾 B、镁 C、汞 D、钠
3. 下列微粒中还原性最强的是:
A、Na+ B、Na C、Mg D、Mg2+
4. 既能溶于盐酸,又能溶于NaOH溶液的是:
A、Si B、Mg C、MgO D、Al2O3
5. 用下列各组物质能制得H2且含杂质最少的是:
A、浓HCl和Al B、浓H2SO4和Al
C、稀HNO3和Al D、稀H2SO4和Al
6. 用等质量的下列各物质和稀H2SO4制取H2,产生H2最多的是:
A、Na B、Mg C、Al D、Zn
7. 下列反应符合实际的是:
A、 MgCl2+H2SO4=MgSO4+2HCl↑
B、 CaCl2+CO2+H2O=CaCO3↓+2HCl↑
C、 BaCO3+Na2SO4=BaSO4↓+Na2CO3
D、 Al2O3+2KOH=2KAlO2+H2O
8. 下列各组离子在水溶液中不能大量共存的是:
A、Na+、SiO32-、SO42-、OH- B、K+、H+、NO3-、SO42-
C、Na+、H+、SiO32-、Cl- D、K+、Na+、HCO32-、OH-
9.下列离子反应方程式正确的是:
A、铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
B、氨水滴入AlCl3溶液中:Al3++3OH-=Al(OH)3↓
C、MgO溶于稀HCl中:O2-+2H+=H2O
D、Al(OH)3溶于稀H2SO4中:OH-+H+=H2O
10.将100ml 2mol/lAlCl3溶液跟一定体积的4mol/lNaOH溶液混合后可得7.8g沉淀。则NaOH溶液的体积可能是:
A、75ml B、150ml C、175ml D、200ml
11.下列关于硬水的叙述中正确的是:
A、硬水中的Ca2+、Mg2+可与肥皂的主要成份结合而生成沉淀,从而浪费肥皂。
B、凡含有Ca2+、Mg2+离子的水都是硬水。
C、暂时硬水在锅炉中长期渚沸所形成的水垢主要成份是CaCO3和MgCO3
D、只具有暂时硬度的水,只需加热渚沸即可得到软化。
12.由两种金属组成的合金10g,投入足量的稀HCl中,完全反应后产生的氢气在标况下的体积为11.2L,则合金可能是:
A、镁、铝合金 B、铁、镁合金 C、铁、锌合金 D、铁、铝合金
13.只用一种试剂就可以将铁粉中的铝粉除去,这种试剂是:
A、稀H2SO4 B、浓NaOH溶液 C、水 D、浓HNO3
14.SiO2与碳在高温下可发生反应:SiO2+3C=SiC+CO↑ 在这一反应中氧化剂与还原剂的质量之比为:
A、1﹕2 B、2﹕1 C、3﹕5 D、5﹕3
15.在K2SO4和Al2(SO4)3的混合溶液中,已知Al3+的浓度为0.2mol/l,SO42-的浓度为0.4mol/l,则该溶液中的K+浓度为:
A、0.1mol/l B、0.2mol/L C、0.3mol/l D、0.4mol/l
16.将铝投入到一定量的NaOH溶液中,充分反应后,有2mol的电子发生了转移。则参加反应的铝的物质的量为:
A、1/3mol B、1mol C、2mol D、2/3mol
二、分析和填空(共30分)。
17.(6分)Mg不但可以在CO2中燃烧,还可以在SO2中燃烧。这两个反应非常相似。试写出Mg条在SO2中燃烧的化学反应方程式,并加以配平。
在该反应中,氧化剂是 ;还原剂是 。电子转移的总数为:
18.(4分)进行铝热反应时可用Fe3O4代替Fe2O3,产生同样的物质。试写出该反应的化学反应方程式,并加以配平。
19.(20分)将3mol/l NaOH溶液滴入到25ml 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。椐图示回答下列问题:
(1)图中A点表示的意义是: 。
B点表示的意义是: 。
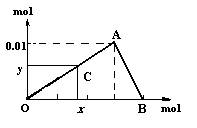 (2)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐
。OA曲线表示的离子反应是:
,由此可得A点的坐标为 ;当C点从A点向B点运动时,表示:
。AB曲线表示的离子反应为:
,由此可得B点的坐标为:
。
(2)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐
。OA曲线表示的离子反应是:
,由此可得A点的坐标为 ;当C点从A点向B点运动时,表示:
。AB曲线表示的离子反应为:
,由此可得B点的坐标为:
。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为: mol/l。
(4)由上可知:生成沉淀的量随加入的OH-的量而改变,可以把它们表示成函数的关系。若以加入的OH-的物质的量x为自变量,以生成的沉淀的物质的量y为因变量,当C点处于OA段时函数表达式为:y= (带定义域);当C点处于AB段时函数表达式为:y= (带定义域)。
(5)利用上述所得结果,填写下表:
| 加入NaOH溶液的体积(ml) | 5.0 | 10.0 | 12.0 |
| 产生的Al(OH)3沉淀的质量(g) |
三 三、计算题(本题共22分)。
20.(10分)镁、铝、铜的合金共10g溶解在过量的盐酸中,产生标况下的氢气5.6L。过滤后在滤液中加入过量的NaOH溶液得白色沉淀5.8g求合金中各金属的质量分数。
21.(12分)Al(OH)3、MgCO3、NaHCO3的混合物共32.4g加入过量HCl生成标况下的气体4.48L,继续向反应后的溶液中加入过量的NaOH溶液,生成5.8g白色沉淀,试计算该混合物中各物质的质量。