高二化学学业水平测试模拟试卷(二) (化学)
一、选择题(每小题3分,共60分。每小题只有一个选项符合题意)
1.下面是人们对于化学科学的各种认识,其中错误的是
A.化学是一门具有极强实用性的科学
B.化学是一门以实验为基础的自然科学
C.化学面对现代日益严重的环境问题显得无能为力
D.化学将在能源、资源的合理开发和安全应用方面大显身手
2.在浓硫酸试剂瓶的标签上应印有下列警示标记中的
A. B.
B. C.
C. D.
D.
3.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭、航班停飞,雾属于下列分散系中的
A.溶液 B.悬浊液 C.乳浊液 D.胶体
4.下列说法中,正确的是
A.摩尔可以把物质的宏观数量(质量、气体体积等)与微观粒子的数量联系起来
B.1mol H就是1mol氢
C.水的摩尔质量和1mol水的质量均可计为18g/mol
D.硫酸和磷酸的摩尔质量相等
5.下列物质不属于“城市空气质量日报”报道的是 ( c )
A.二氧化硫 B.二氧化氮 C.二氧化碳 D.悬浮颗粒
6.下列叙述中,正确的是 ( a )
A.复分解反应一定都属于非氧化还原反应
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
7.下列物质中属于非电解质的是 ( b )
A.NaOH B.CO2 C.H2SO4 D. Fe
8.下列反应中水只作还原剂的是 ( c )
A.2Na +2H2O = 2NaOH + H2↑ B.2Na2O2 + 2H2O = 4NaOH + O2↑
C.2F2 + 2H2O = 4HF + O2 D.Cl2 + H2O = HCl + HClO
9.物质燃烧时,火焰呈紫色的一定含有 ( B )
A.钾原子 B.钾元素 C.钾离子 D.钾的化合物
10.做焰色反应时,使用的铂丝每次都要用试剂洗净,这种试剂指的是 ( C )
A.NaOH溶液 B.碳酸钠溶液 C.稀盐酸 D.硫酸溶液
11.清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的b
A.实验 B.假设 C.观察 D.总结
12.下列各组中的离子,能在溶液中大量共存的是d
A.K+、H+、SO42-、OH- B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32- D.Na+、Cu2+、Cl-、SO42-
13.下列溶液与20mL1mol/LNaNO3溶液中的NO3-物质的量浓度相等的是c
A.5mL1mol/LMg(NO3)2溶液 B.5mL0.8mol/LAl(NO3)3溶液
C.10mL0.5mol/LCu(NO3)2溶液 D.10mL2mol/LAgNO3溶液
14.胶体区别于其它分散系的本质特征是:b
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能。
B.分散质粒子直径在10-9~10-7m之间。
C.产生丁达尔现象。
D.胶体是纯净物,其它分散系是混合物。
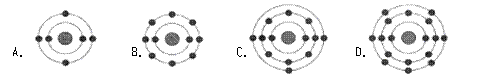 15.已知最外层电子数相等的元素原子具有相似的化学性质。氟原子的核外电子分层排布示意图为
15.已知最外层电子数相等的元素原子具有相似的化学性质。氟原子的核外电子分层排布示意图为![]() ,下列原子中,与氟原子的化学性质相似的是d
,下列原子中,与氟原子的化学性质相似的是d
16随着卤族元素核电荷数的增大,下列递变规律正确的是……………( )
A.单质的颜色逐渐加深
B.单质的熔沸点逐渐降低
C.单质的密度逐渐增大
D.单质在水中的溶解度逐渐增大 .
17关于合金性质的说法中,错误的是 ( d )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
18一些科学家预言,存在稳定的超重元素,如:N=184的原子,它位于元素周期表第七周期,第ⅣA族.由此,下列说法正确的是………………( )
A.第七周期有50种元素
B.该原子的质子数是184
C.该元素相对原子质量是298
D.该原子核外有114个电子
 19下列电子式正确的是( )
19下列电子式正确的是( )
20.叙述正确的是( )
A、39K+和40Ca2+微粒中的电子数和中子数都相等
B、D2和He在同温同压时,若体积相等,则质量不相等
C、同一元素的各种同位素的物理性质、化学性质均相同
D、两个质量数和电子数都相等的微粒一定是同种元素
二.填空题(40分)
24(6分)用电子式表示下列化合物的形成过程:
(1)CH4
(2)MgCl2
25(8分)在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又有极性键的是 。
26.(4分)下列实验操作中错误的是(填写序号)_______________________。
A.蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热
B.将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体
C.蒸馏和测定中和反应反应热时,温度计水银球均需浸没在液体中
D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
E.选用酒精作为萃取剂从碘水中萃取碘。
F.把氢氧化钠固体放在托盘天平左盘的滤纸上称量
G.用酒精灯的外焰给试管中的物质加热
H.过滤操作中,为了加快过滤可用玻璃棒在漏斗中轻轻搅拌
27(10分)利用氧化还原反应2FeCl3+Cu=2FeCl2+CuCl2,设计一个原电池装置。要求:
⑴ 画出装置图,标明电极材料和电解质溶液; ⑵ 写出电极反应式。
28(12分).取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr的水溶液中,经加热蒸发水分并烘干后,得质量为13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2多少克?
(3)软锰矿含MnO2的质量分数。