高二化学学业水平测试期末考试试卷
l 考试时间100分钟,试卷总分100分。
l 选择题部分请涂答题卡,其余直接写在答卷上。不按要求答卷不计分;
l 可能用到的相对原子质量:H—1 C—12 O—16 N—14 S—32
Cl—35.5 Fe—56 Ba—137 Al—27 Mg—24 Na—23
Ⅰ卷 选择题
一、选择题(每小题只有一个正确答案)(每题3分共60分)
1.下列玻璃仪器:①烧杯 ②烧瓶 ③试管 ④容量瓶 ⑤量筒。能直接加热的是:
A.①③ B. ②③ C. ③ D. ④⑤
2.为了使江苏的天更蓝,空气更清新,目前南京市对没有申领到“绿色”通行证的高污染车实行限行。高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有
A、 二氧化碳 B、氮氧化物
C、 水蒸汽 D、 氮气
3.现有三组溶液,①汽油和氯化钠溶液;②乙醇和CCl溶液的混合物;③氯化钠和单质碘的水溶液,分离以上各混合物的正确方法依次是: ( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
4.下列叙述中正确的是
A.摩尔是物质的质量的单位 B.碳的摩尔质量为12g
C.阿伏加德罗常数约为6.02×1023mol-1 D.一个碳原子的质量为12g
5.能够将溶液和胶体区分开的方法是( )
A.过滤 B.观察颜色、状态
C.利用丁达尔效应 D.闻气味
6.下列物质中含有自由移动的Cl-是
A.KClO3溶液 B.KCl溶液
C.液态HCl D.NaCl固体
7.同温同压下,相同体积的氧气和氨气,可以肯定的是
A.质子数相等 B.分子数不等
C.都含有6.02×1023 个分子 D.物质的量相等
8.下列物质转化需要加入还原剂才能实现的是
A.SO32-→SO2 B.HCl→Cl2
C.Na→Na+ D.SO2→S
9.在实验室中,对下列实验、事故或药品的处理正确的是 ( )
A、加热液体的试管口不能正对着自己或别人
B、金属钠着火燃烧时,用泡沫灭火器灭火
C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D、含硫酸的废液倒入水槽,用水冲入下水道
10.下列溶液的溶质都是强电解质,这些溶液中的Cl-浓度与50mL 1mol·L-1 MgCl2溶液中的Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液 B.75 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 KCl溶液 D.75 mL 1 mol ·L-1 AlCl3溶液
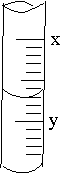 11. 右图是 10ml 量筒的一部分,数字XY之间相差 1ml
11. 右图是 10ml 量筒的一部分,数字XY之间相差 1ml
若 X=5,则量筒所盛液体的体积是
A. 5.7 ml B. 4.4 ml C. 4.3 ml D. 6.3 ml
12.下列离子方程式书写正确的是
A.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
B.铁粉投入到硫酸铜溶液中:Fe +Cu2+=Fe2+ +Cu
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
D.澄清石 灰 水 跟 稀 硝 酸 反 应: Ca(OH)2+2H+=Ca2++2H2O
13.下列离子在溶液中能大量共存的是
A.Ba2+、SO42- 、K+、 OH- B.![]()
C.Al3+、HCO3- 、K+、 OH- D.![]()
14.光纤通信是以光作为信息的载体,让光在光导纤维中传播,制造光导纤维的基本原料是
A.硅 B.铜 C.二氧化硅 D.铝
15.下列有关实验室制取蒸馏水的实验装置与操作的说法中,不正确的是
A.温度计的水银球应插入烧瓶的自来水中
B.冷凝管中的水流方向是从下口进入,上口排出
C.实验中需要在烧瓶中加入几粒碎瓷片,防止出现暴沸现象。
D.烧瓶必须垫加石棉网加热。
16.下列对硫酸的叙述正确的是
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸不活泼,可用铁铝容器存放
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.浓硫酸具有腐蚀性,取用时要小心
17.下列操作不能用于检验![]() 的是
的是
A.气体使湿润的酚酞试纸变红 B.气体能使湿润的红色石蕊试纸变蓝
C.气体与浓H2SO4靠近 D.气体与浓盐酸产生白烟
18.除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及其顺序正确的是
A、Na2CO3、AgNO3、HNO3 B、AgNO3、Na2CO3、HCl
C、AgNO3、Na2CO3、HNO3 D、AgNO3、K2CO3、HNO3
19.按照HCl、( )、Ca(ClO)2、Cl2O5、HClO4的排列规律,选出一种适当的物质填入括号
A.NaCl B.NaClO C.Cl2O7 D.Cl2
20.NO2被水吸收的过程中,发生了氧化还原反应3NO2+H2O=2HNO3+NO,其中被氧化的N原子和被还原的N原子,其物质的量之比是
A.3:1 B.1:3 C.1:2 D.2:1
Ⅱ卷 非选择题
二、填空题(30分)
21.经科学测定,人体平均含氧65%,含碳18%,含氢10%(以上均为质量分数),则三种元素中原子数目最多的是 (填元素符号)。
22.已知有以下物质相互转化。试回答:
|

(1)写出B的化学式 ,D的化学式 。
(2)写出由D转变成H的化学方程式 。
(3)写出向G溶液加入A的有关离子反应方程式 。
23.相对原子质量均大于10的A、B两种元素,能形成两种化合物X、Y。已知X和Y的相对分子质量之比15︰22,X和Y的质量之比为3︰4.4。经测定X的组成为AB,Y的组成为AnB。试通过计算确定:
(1)A、B两种元素的名称:A__________________;B___________________。
(2)X、Y的分子式:X___________________;Y_____________________。
三、计算题(10分)
24.取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
高二化学学业水平测试期末考试试卷
答题纸
II 卷
班级 学号 姓名
二、填空题
21. (填元素符号)。
22.
(1)B的化学式 ,D的化学式 。
(2)D转变成H的化学方程式 。
(3)G与A反应的离子反应方程式 。
23.
(1)元素名称:A__________________;B___________________。
(2)分子式:X___________________;Y_____________________。
三、计算题
24.
答案:1C 2 B 3 C 4 C 5 C 6 B 7 D 8 D 9 A 10 C 11 C 12 B 13 B 14 C 15 A
16 D 17 C 18 D 19 B 20 D 21 H
22 FeCl2 KCl KCl + AgNO3 = AgCl↓+KNO3 2Fe3+ + Fe = 3Fe2+
23 A:氮;B:氧;X:NO;Y:N2O 24 0.9mol 0.01mol