高二化学月考卷2
第I卷(选择题,共72分)
一、选择题(每小题4分,共32分。每小题只有1个选项符合题意)
1、下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是
A、HCl、CaCO3、SO2 B、HClO、H2S、C2H5OH
C、KNO3、CH3COOH、NH3 D、BaSO4、H3PO4、H2O
2、下列事实一定能说明HNO2为弱电解质的是: ①常温时NaNO2溶液的PH大于7; ②用HNO2溶液做导电实验灯泡很暗; ③HNO2与NaCl不能反应; ④常温下0.1mol/L的HNO2溶液PH=2.
A.①②③ B.①②④ C.①④ D.②④
3、某酸溶液的pH = 1,此酸溶液的物质的量浓度
A、0.1 mol · L-1 B、一定大于0.1 mol · L-1
C、若为强酸一定等于0.1 mol · L-1,若为弱酸一定大于0.1 mol · L-1
D、若为强酸一定 ≤ 0.1 mol · L-1,若为弱酸一定>0.1 mol · L-1
4、有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它 们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A、V3>V2>V1 B、V3=V2=V1 C、V3>V2=V1 D、V1=V2>V3
5、PH值等于3的醋酸和盐酸各10 mL,分别稀释100倍,则醋酸溶液的PH
A、大于盐酸溶液 B、小于盐酸溶液
C、等于盐酸溶液 D、是盐酸溶液PH值的3倍
6、将1 L PH = 3的醋酸溶液加入水稀释到10 L后,下列微粒浓度增大的是
A、c[ CH3COOH ] B、c[ H+ ] C、c[ OH— ] D、c[ CH3COO— ]
7、在一定条件下发生下列反应,其中属于盐类水解反应的是 A、NH4+ +2 H2O ![]() NH3·H2O + H3O+ B、HCO3— + H2O
NH3·H2O + H3O+ B、HCO3— + H2O ![]() H3O+ + CO32—
H3O+ + CO32—
C、HS-+H+ ![]() H2S D、Cl2+H2O
H2S D、Cl2+H2O ![]() H++Cl-+HClO
H++Cl-+HClO
8、室温下,已知1L溶液中已电离的水是![]() mol,则此溶液中可能大量存在的离子组是①Na+、K+、
mol,则此溶液中可能大量存在的离子组是①Na+、K+、![]() 、HCO3-- ②
、HCO3-- ②![]() 、
、![]() 、Na+、K+ ③
、Na+、K+ ③![]() 、K+、
、K+、![]() 、
、![]()
④![]() 、K+、
、K+、![]() 、
、![]() ⑤
⑤![]() 、
、![]() 、
、![]() 、
、![]()
A.除①外,均可以 B.① C.②③⑤ D.②③④
9、NA为阿伏加德罗常数,下列说法正确的是
A、1molFe3+完全水解生成氢氧化铁粒子的数目为NA
B、1mol/L的Ba(OH)2溶液中阴阳离子数目为3 NA
C、1LPH=1的水溶液中,溶液水合氢离子数为0.1NA
D、常温时,2L1mol/L的乙酸溶液中,所含分子总数大于2NA
10、25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)Fe(SO4)2的溶液中,测得C(NH4+) 分别为a、b、c(单位为mol/L)。下列判断正确的是
A、a = b = c B、a > b > c C、a > c > b D、c > a >b
11、物质的量浓度相同的三种盐 NaX、NaY 和 NaZ 的溶液,其中pH值依次为 8、9、10,则 HX、 HY、HZ 的酸性由强到弱的顺序是
A、HX、HZ、HY B、HZ、HY、HX
C、HX、HY、HZ D、HY、HZ、HX
12、Na2CO3溶液中,存在多种分子和离子,下列关系式中不正确的是
A、c [OH-] = c [HCO3-] + c [H+] + 2 c [H2CO3]
B、c [Na+] > c [CO32-] > c [OH-]> c [HCO3-] > c[H+]
C、c [Na+] = c [CO32-] + c [HCO3-] + c [H2CO3]
D、c [OH-] + c [HCO3-]+ 2 c [CO32-] = c [H+] + c[Na+]
13、下列离子方程式中书写正确的是
A、硫化钠溶于水中:S2-+2H2O ![]() H2S↑+2OH-
H2S↑+2OH-
B. FeCl3水解:FeCl3 + 3 H2O = Fe(OH)3↓+ 3 H+
C. 碳酸氢钠溶液和氯化铝反应:3HCO3- + Al3+== Al(OH)3 ↓+3 CO2↑
D. 氨水中加入明矾溶液 3 OH- + Al3+ === Al(OH)3↓
14、常温时,将下列溶液等体积混合后,所得混合液的pH小于7的是
A、pH为2的醋酸溶液与pH为12的氢氧化钠溶液
B、0.0l mol·L-1 的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液
C、pH为2的硫酸溶液与pH为12的氢氧化钠溶液
D、0.010 mol·L-1的盐酸溶液与0.010 mol·L-1的氢氧化钡溶液
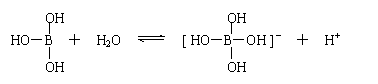 15、某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中只有一步电离过程,为:
15、某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中只有一步电离过程,为:
下列判断正确的是
A、该反应为水解反应 B、硼酸是三元酸 C、硼酸是两性氢氧化物
D、硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-=[B(OH)4]-
16、常温下,pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合溶液的叙述正确的是
A、c(R2-)>c(Na+)>c(H+)=c(OH-) B、2c(R2-)+c(HR-)=c(Na+)
C、c(R2-)+c(OH-)=c(Na+)+c(H+) D、混合液的体积为2a L
17、A+、B+、C-、D-四种离子两两组成可溶性盐,其中:AC盐与BD盐溶液PH=7,BC盐溶液PH>7,则下列说法不正确的是
A、 AD盐溶液PH>7 B、在AC盐溶液中:[A+]+[AOH]=[C-]+[HC]
C、将AD盐和BC盐等物质的量混合溶于水,溶液PH=7
D、酸电离程度一定是:HD>HC
18、PH值均为2的盐酸和醋酸各100mL,分别稀释100倍,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A、醋酸与锌反应放出的氢气多 B、放出氢气酸醋酸与盐酸一样多
C、醋酸与锌反应速率快 D、盐酸和醋酸与锌反应的起始速率一样
第II卷(非选择题,共78分)
三、19.(17分)(1)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);②使用时必须检查是否漏水的有 (填序号);
(2)现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;
②若在滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
③做中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液2滴,(i)滴定时,边滴边摇荡,(j)边注视滴定管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定。(l)记录液面刻度读数。(m)根据滴定管的两次读数得出NaOH溶液体积为22 mL。指出上述实验错误之处(用编号表示) _____。


(4) 有一锥形瓶盛有用盐酸滴定过的氢氧化钠溶液(酚酞作指示剂),溶液已呈无色,如何确定是刚好滴到终点?还是盐酸过量? 请用简洁的文字说明:
20、(12分)为了证明一水合氨是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.01 mol/L氨水、0.1 mol/L NH4Cl溶液、NH4Cl晶体、酚酞试剂、PH试纸、蒸馏水
(1)甲用PH试剂测出0.01 mol/L氨水的PH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?(填是或否) 并说明理由:
(2)乙取出10 mL 0.10 mol/L氨水,用PH试纸测出其PH = a,然后用蒸馏水稀释至1000 mL,再用PH试纸测出其PH为b,若要确认一水合氨是弱电解质,则a、b值应满足什么关系? (用等式或不等式表示)
(3)丙取出10 mL 0.10mol/L氨水,滴入2 滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变(填深或浅) 。你认为这一方法能否证明一水合氨是弱电解质? (4)请你根据所提供的试剂,再提出一个合理又简便的方案证明一水合氨是弱电解质。
四、21、(14分)(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c[Na+] > c[CN-],用“>、<、=”符号填空
①溶液中c[OH -] c[H +] ② c [HCN] c[CN-]
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是: (A) 逐渐减小; (B) 逐渐增大; (C) 先逐渐增大,而后减小; (D) 先逐渐减小,而后增大. 你的选择是
(3)pH值相同的 HCl(aq) 、H2SO4(aq) 、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。(填A、HCl最快 B、H2SO4最快
C、CH3COOH最快 D、一样快)
(4)某温度下,纯水中的c [H+] = 2.0×10-7 mol/L,则此时c [OH-] = mol/L。相同条件下,测得① NaHCO3(aq) ② CH3COONa(aq) ③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
22、(7分)25℃时,氢硫酸氢钾溶液里存在着下列平衡:
(a) HS-
+ H2O ![]() OH- +H2S (b)HS-
OH- +H2S (b)HS-![]() H++S2-
H++S2-
(1)_______是电离平衡;_______是水解平衡。
(2)当向其中加入硫酸铜溶液时,生成了CuS 沉淀,则电离平衡向______________移动;水解平衡向______________移动;c [H+]变(填大或小) ________________;
(3)当向其加入氢氧化钠固体时, c [S2-]变(填大或小)________。
(4)若将溶液加热至沸腾,c[OH -]· c[H +] 将变(大或小)______。
五、23、(9分)
(1)在实验室里600℃灼烧MgCl2•6H2O晶体,最后得到的固体物质分别是_________,
原因是_____________________________________________________?.
(2)将PH=12的氢氧化钡溶液和0.01摩/升的盐酸反应,当反应溶液的PH=7时,所消耗的氢氧化钡溶液和盐酸溶液的体积比是_________
(3)物质的量浓度相同的下列溶液:① NaOH②HCl③NaHCO3④Na2CO3⑤NaCl⑥Na2SiO3⑦NH4Cl⑧H2SO4⑨(NH4)2SO4⑩Ba(OH)2 pH由大到小的顺序是:
(4)物质的量浓度相同的下列溶液:① NH4HCO3 ② (NH4)2CO3 ③ KHCO3④K2CO3⑤H2CO3
CO32-的浓度由大到小的顺序是
24、(4分)一杯敞口放置的NaOH溶液,为了证明它是否已经变质(水未蒸发),进行了以下实验:① 取15.00mL该溶液放入锥形瓶中,滴入2~3滴甲基橙指示剂,用1.0000mol/L的标准盐酸滴定,至滴定终点时共用去盐酸22.50mL。②另取15.00mL该溶液放入锥形瓶中,滴入2~3滴酚酞指示剂,用1.0000mol/L的标准盐酸滴定,至滴定终点时共用去盐酸18.75mL。通过计算回答:
上述溶液的组成 及其物质的量浓度 ?
六、25、(9分)氢氧化钡(相对分子量171)是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 _____ 。
26、(6分)维生素C(又名抗坏血酸,分子式为C6H8O6,分子量176)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2 == C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,共消耗21.00 mL I2溶液。
(1) 为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2) 滴定终点时溶液由___色变为___色
(3) 计算样品中维生素C的质量分数。
高二化学答题卷
(选择题做在答题卡上)
第II卷(非选择题,共78分)答题卷
三、19.(17分)
(1) ① (填序号);
② (填序号);
(2) ①该进行的操作是
②偏 。
③ (用编号表示) 。
(3) mL, mL。 mL。
(4)请用简洁的文字说明:
20、(12分) (1)(填是或否) 并说明理由:
(2) (用等式或不等式表示)
(3) 。你认为这一方法能否证明一水合氨是弱电解质?
(4)
四、21、(14分)
(1)① ②
(2) 你的选择是
(3) ①最大的是
②最多的是
③
(4)c [OH-] = mol/L。物质的量浓度由大到小的顺序是
22、(7分)
(1)_______是电离平衡;______是水解平衡
(2) 电离平衡向____________移动;水解平衡向_________移动;c [H+]变(填大或小) _____________ ;
(3) c [S2-]变(填大或小)________。
(4) c[OH -]· c[H +] 将变(大或小)______。
五、23、(9分)
(1)固体物质是_______
原因是______________________________________?.
(2)体积比是_________
(3)pH由大到小的顺序是:
(4)浓度由大到小的顺序是
24、(4分) 组成之一 其物质的量浓度
组成之二 其物质的量浓度
六、25、(9分)
(1) 求试样中氢氧化钡的物质的量。
(2) 求Ba(OH)2·nH2O中的n值。
(3) 试样中Ba(OH)2·nH2O的质量分数
26、(6分)
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)滴定终点时溶液由___色变为___色
(3)计算样品中维生素C的质量分数。