高二化学提高测试1
一、选择题(本大题共30分,每小题有1~2个选项符合题意)
1.受热时有红棕色气体放出,并留下黑色残渣的是( )
①Ca(NO3)2 ②NaNO3 ③Cu(NO3)2 ④NH4NO3
A.只有①和② B.只有③ C.只有③和④ D.只有②
2.下列比较正确的是( )
A.硝酸的酸性比磷酸强 B.PH3的稳定性大于NH3
C.PH3的还原性大于NH3 D.氮气的化学性质比磷活泼
3.鉴别二氧化氮和溴蒸气,下列哪一种方法最可靠( )
A.嗅气味 B.用湿润的淀粉碘化钾试纸
C.看颜色 D.用AgNO3溶液
4.有A、B两种物质,A和B化合生成C,C溶于水生成D,D和红热木炭反应又生成C,则A和B分别是( )
A.O2和SO2 B.N2和O2 C.NO和O2 D.H2和Cl2
5.下列各离子方程式正确的是( )
A.磷酸二氢钙溶液中加入适量氢氧化钙溶液
H2PO4-+2OH-=PO43-+2H2O
B.铜跟稀硝酸反应
3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
C.氨水通入过量二氧化碳
NH3·H2O+CO2=NH4++HCO3-
D.固体氯化铵和消石灰混合,并加热
NH4++OH-=NH3↑+H2O
6.能将Na2SO4、NH4NO3、KCl、(NH4)2SO4四种无色溶液加以区别的一种试剂是(必要时可以加热)( )
A.AgNO3 B.NaOH C.BaCl2 D.Ba(OH)2
7.由于可能发生氧化还原反应,而在溶液中不能大量共存的离子组是( )
A.Na+、NO3-、HCO3-、OH- B.NO3-、S2-、NH4+、H+
C.H+、Na+、SO42-、CO32- D.I-、NH4+、NO3-、H+
8.锌与某浓度的硝酸发生氧化还原反应,其物质的量之比为2∶5,则硝酸的还原产物是( )
A.N2O B.NO2 C.NO D.NH4NO3
9.在一定条件下,下列各物质发生反应时,参加氧化还原反应的氧化剂与还原剂物质的量之比为1:2的是( )
A.Cu+HNO3(浓) B.NO2+H2O C.Cu+H2SO4(浓) D.MnO2+HCl(浓)
10.下列各组物质在不同条件反应时,均能得到不同的产物,其中主要是由温度不同引起的是( )
①P、Cl2 ②Cu、浓HNO3 ③NaCl、H2SO4 ④H2S、O2 ⑤CO2、NaOH ⑥P2O5、H2O ⑦C、O2
A.①② B.③⑦ C.③⑥ D.②⑤
11.NH4ClO4在强热条件下分解的产物为N2、O2、HCl和H2O。则反应中生成的氧化产物与还原产物的物质的量之比为( )
A.2∶4 B.5∶4 C.4∶7 D.7∶4
12.碘化磷(PH4I)是一种白色晶体。根据你所学的知识,判断下列关于碘化膦的描述错误的是( )
A.它是离子晶体,稳定,高温也不分解
B.它的水溶液使淀粉变蓝
C.能跟强碱反应放出PH3
D.该物质中含有共价键、配位键和离子键
13.将干燥的CO2通入足量固体Na2O2后,继续通入盛有80 mL NO倒立于水槽的大试管中,充分反应后,大试管内气体是原来的一半。则干燥的CO2体积为( )
A.30 mL B.60 mL C.100 mL D.200 mL
14.将12.8 g铜跟适量浓HNO3反应铜全部作用后,共收集到气体5.6 L(标况),反应消耗HNO3的物质的量可能是( )
A.0.65 mol B.0.25 mol C.0.8 mol D.1 mol
15.含有(NH4)2SO4、NH4NO3的混合溶液v L,加入a mol NaOH溶液后加热,恰好使NH3全部逸出;又加入b mol BaCl2刚好使SO42-完全沉淀,则原混合液中NH4NO3的物质的量浓度为( )
A.
ab mol/L B.![]() mol/L
C.
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
二、填空题(本大题共34分)
16.某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色变浅的原因是:______________
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是_____溶液;加热时溶液由无色变为红色的原因是_______________。
17.在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O.
(1)RO3n-中R元素的化合价是____________。
(2)R元素的原子最外层的电子数是
18.在一定的温度和压强,4体积的某气态氢化物完全分解后,生成1体积的磷蒸气和6体积的氢气。此氢化物的化学式为_______,此反应的化学方程式为_______。
19.实验室中有一瓶已呈黄色的浓硝酸,这是由于其中含有_______。请设计简单方法除去杂质(不得降低硝酸的浓度)________,有关反应的化学方程式为_________。
20.实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
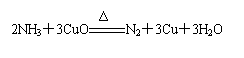 ,
,

试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量(mCuO,mH2O)时,请用下列仪器设计一个简单的实验方案。
①仪器连接的顺序(用字母编号表示,仪器可重复使用)
D中浓硫酸的作用是_____________________。
实验完毕时观察到A中的现象是___________。
②列出计算Cu的相对原子质量的表达式____________。
③下列情况将使测定结果偏大的是_______________。
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有
A.mCu和mCuO
B.![]() 和
和![]()
C.mCu和![]() D.
D.![]() 和
和![]()
三、推断题(本大题共18分)
21.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:①反应前的X与反应后生成的Z的物质的量之比n(X) : n(Z)=2 : 3 ②单质Y的分子为正四面体构型。请填写下列空白:
(1)单质Y是__________,单质Z是__________(填写名称或分子式)。
(2)Y分子中共含_________个共价键。
(3)X分解为Y和Z的化学方程式为______________。
22.把某黑色固体A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X,将X作如下图所示实验:
 白色沉淀
白色沉淀
无色气体C
无色气体E
蓝色溶液G
无色溶液D
无色气体E
由此可判断:A的名称是_________,B的名称是________;C是_______、D是_________、R是________、E是________、G是________、X是________。
四、计算题(本大题共18分)
23.在一定条件下,NO跟NH3可发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4 g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
24.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
① 2KNO32KNO2+O2↑
② 2Cu(NO3)3 2CuO+4NO2+O2↑
③ 2AgNO3 2Ag+2NO2+O2↑
今有固体可能由上述三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的![]() 。通过计算(忽略氧在水中的溶解)回答:
。通过计算(忽略氧在水中的溶解)回答:
(1)该固体是否可能只是由一种盐组成的?若可能,指出是哪种盐。
(2)若固体是混合物,指出它的可能组成(物质的量之比)。
参考答案
一、选择题
1.B
2.A、C
3.D
4.C
5.B、C
6.D
7.B、D
8.A、D提示:在锌与硝酸的反应中,硝酸起两个作用,一部分起酸的作用,另一部分起氧化剂的作用。如果降价后的氮元素仍为正价,则酸的物质的量是锌的物质的量的2倍,即5份硝酸中有4份做酸,1份做氧化剂,按得失电子守恒的原则,2份锌所失电子等于1份硝酸所得电子,氮元素由+5价降为+1价,选A;如果氮元素降为-3价,即还原产物为硝酸铵时,2份锌可还原![]() 份硝酸,4份硝酸与锌成盐,
份硝酸,4份硝酸与锌成盐,![]() 份与还原产物成盐,需硝酸总量恰好为5份,符合题意,选D。
份与还原产物成盐,需硝酸总量恰好为5份,符合题意,选D。
9.B、D
10.C
11.D提示:根据题意可写出反应方程式:4NH4ClO4=2N2+5O2+4HCl+6H2O
![]() 其中:N元素 -3 0 ∴N2为氧化产物
其中:N元素 -3 0 ∴N2为氧化产物
![]() O元素 -2
0 ∴O2为氧化产物
O元素 -2
0 ∴O2为氧化产物
![]() Cl元素 +7 -1 ∴HCl为还原产物
Cl元素 +7 -1 ∴HCl为还原产物
12.A、B
13.B、D提示:将干燥的CO2通入足量同体Na2O2后,继续通入盛有80 mL NO倒立于水槽的大试管中,反应为:2CO2+2Na2O2=2Na2CO3+O2,3O2+4NO=4HNO3,充分反应后气体剩余40 mL。如果剩余气体为O2,则原试管中80 mL NO全部反应,消耗O2的体积为60 mL,O2的总体积为100 mL,所以通入的CO2的体积为200 mL;如果剩余气体为NO,则反应了的NO为40 mL,消耗O2的体积为30 mL,CO2的体积为60 mL。
14.A
15.D
16.(1)稀氨水和酚酞 稀氨水中的氨气逸出,所以溶液的颜色变浅
(2)溶有二氧化硫的品红 二氧化硫气体逸出,品红溶液恢复红色
17.(1)+5 (2)7 提示:任何元素的负化合价只有一种(除表观化合价),即为最外层电子数减8。由题意可知,元素R有R-离子,所以R元素有负价-1,由此可知R元素的原子最外层的电子数是7。
18.PH3 4 PH3=P4+6H2
19.NO2,通O2,4NO2+O2+2H2O=4HNO3
20.(1)①BCACD;吸收未反应的NH3,防止空气中的水蒸气进入装置;固体由黑色变为亮红色。② ③A,C
(2)A,C
21.(1)白磷(或P4),氢(或H2)
(2)6 (3)4PH3=P4+6H2
22.木炭,浓硝酸;CO2和NO、稀HNO3、Cu、NO、Cu(NO3)2、CO2和NO2
四、计算题
12e
![]()
6NO+4NH3=5N2+6H2O
(2)两组解:
0.3 mol NO和0.7 mol NH3
0.8 mol NO和0.2 mol NH3
提示:6NO+4NH3=5N2+6H2O 还原得N2-氧化得N2
6 mol 4 mol 3 mol-2 mol=1 mol(或28克)
设参加反应的NO和NH3的物质的量分别为x和y 则:
![]()
∴ x=0.3 mol y=0.2 mol
据题意,原混合物总量为1 mol,所以充分反应后有0.5 mol剩余物。
若剩余物为NO,则原混合物中NO的物质的量为:0.5 mol+0.3 mol=0.8 mol
NH3的物质的量为:0.2 mol
若剩余物为NH3,则原混合物中NH3的物质的量为:0.5 mol+0.2 mol=0.7 mol
NO的物质的量为:0.3 mol
24.(1)AgNO3
提示:(1)2KNO32KNO2+O2↑
②2Cu(NO3)22CuO+4NO2+O2↑
③2AgNO3Ag+2NO2+O2↑
4NO2+O2+2H2O=4HNHO3
若只有KNO3,则气体经水充分吸收后体积不变。
若只有Cu(NO3)2,则气体恰好被水完全吸收,无剩余气体。
若只有AgNO3,则气体被水吸收后,O2有剩余,恰好为原混合气体体积的![]()
(2)KNO3和Cu(NO3)2。的物质的量之比为1∶1,AgO3的物质的量可以任意变动。
提示:由(1)可知,当NO2与O2的体积比为2∶1时恰好符合题意,所以混合物中硝酸银的物质的量可以任意变动。由2KNO3 2KNO2+O2↑和2Cu(NO3)2 2CuO+4NO2+O2↑可得,要使二者混合物受热分解放出的NO2和O2体积比为2:1,则二者物质的量之比为1∶1。