高二化学提高测试2
一、选择题(10分,每小题2分,每小题只有1个选项符合题意)。
1.反应mA(气)+nB(气)pC(气)+qD(气),测得平均反应速率vC=2vB,达到平衡后,若保持温度不变,给体系加压,平衡不移动,则m,n,p,q数值正确的是( )
A.2,6,3,5 B.3,1,2,2
C.3,1,2,1 D.1,3,2,2
2.在溶液中发生的反应,对反应速率不发生显著影响的是( )
A.浓度 B.温度 C.压强 D.反应物的性质
3.硫燃烧的主要产物是SO2,但也有少量的SO3生成。对于后一过程,温度的影响大于浓度的影响。取一定量的硫在容积相同的空气中和纯氧中燃烧,产生SO3的体积分数分别为a和b,则a和b关系正确的是( )
A.a>b B.a<b C.a=b D.无法确定
4.在一定条件下,可逆反应SO2+NO2SO3+NO达到平衡后,再通入适量的O2,则平衡( )
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
5.在一定温度下,可逆反应A(气)+3B(气)2C若达到平衡的标志是( )
A.C的生成速率与B的生成速率相等
B.A,B,C的浓度不再发生变化
C.单位时间内生成A n mol,同时生成B 3n mol
D.A,B,C的分子数之比为1∶3∶2
二、多项选择题(40分,每小题4分,每小题有1~2个选项符合题意)。
6.对于可逆反应:CO2(气)+C(固)2CO(气)-Q,下列各组条件变化时,两项均能使平衡向右移动的是( )
A.加压,升温 B.加压,降温
C.减压,降温 D.减压,升温
7.同温同压下,当反应物分解8%时,总体积也增加8%的是( )
A.2NH3(气)N2(气)+3H2(气) B.2NO(气)N2(气)+O2(气)
C.2N2O5(气)4NO2(气)+O2(气) D.2NO2(气)2NO(气)+O2(气)
8.在汽车引擎中,N2和O2进行反应会生成污染大气的NO,N2+O22NO+Q,有人认为,废气排出后,温度即降低,NO分解,污染也就会自行消失,事实证明,此说法是错误的,其主要原因可能是( )
A.常温常压下NO分解速率很慢
B.在空气中NO迅速变成NO2而不分解
C.空气中O2和N2的浓度高,不利于平衡向左移动
 D.废气排出,压强减小,不利于平衡向左移动
D.废气排出,压强减小,不利于平衡向左移动
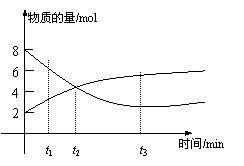
9.在一定温度下,容器内某一反应中M、N的
物质的量随反应时间变化的曲线如图,下列表述中
正确的是( )
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
10.Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2OFe(OH)2+2H+
往该溶液中滴加盐酸,发生的变化是( )
A.平衡向逆反应方向移动 B.平衡向正反应方向移动
C.溶液由浅绿色变成黄色 D.溶液由浅绿色变为深绿色
11.在一固定容积的容闭容器中,加入2 L X和3 L Y气体,发生如下反应:n X(气)+3Y(气)2Z(气)+R(气),反应平衡时,则知X和Y的转化率分别为30%和60%,则化学方程式中的n值为( )
A.1 B.2 C.3 D.4
12.对于反应2NO2(气)N2O4(气),在一定条件下达到平衡,在温度不变时,欲使![]() 的比值增大,应采取的措施是( )
的比值增大,应采取的措施是( )
A.体积不变,增加NO2的物质的量;
B.体积不变,增加N2O4的物质的量;
C.使体积增大到原来的2倍;
D.充入N2,保持压强不变
13.下列叙述,能肯定判断某化学平衡发生移动的是
A.反应混合物的浓度改变 B.反应混合物中各组分的含量改变
C.正逆反应速率改变 D.反应物的转化率改变
14.在2A+3BxC+yD的可逆反应中,A,B,C,D均为气体,已知起始浓度A为5 mol/L,B为3 mol/L,C的反应速率为0.5 mol/(L·min),反应开始至平衡需2 min,平衡时D的浓度为0.5 mol/L,下列说法正确的是( )
A.A和B的平衡浓度比为5∶3 B.x∶y=2∶1
C.A和B的平衡浓度比为8∶3 D.x=1
15.在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(气)+B(气)x C(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
三、填空题
16.反应n A(气)+m B(气)p C(气)达到平衡后,当升高温度时,B的转化率度大,当减压后混合体系中C的百分含量减少(其他条件不变),试推测逆反应是_______热反应,m+n___ _P(填<,>,=),当改变下列条件(其它条件不变),填入项目的变化情况:
(1)减压后,A的百分含量_____;加入B,A的转化率_________;
(2)升温后[B]/[C]将变_______;降温时,混合气体的平均相对分子质量_______;
(3)使用催化剂,气体混合物的总物质的量___________。
17.近年来,某些自来水厂在用液氯进行消毒处理时还加入少量的液氨,其反应的化学方程式为:NH3+HClOH2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因是______________________。
18.抽烟对人体有害。烟草不完全燃烧产生的CO被吸进肺里跟血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb·O2O2+Hb·CO,实验表明,Hb·CO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。
试回答:(1)上述反应的平衡常数表达式为K=________________。
(2)抽烟时,吸入肺里的空气中测得CO和O2的浓度分别为10-6 mol/L和10-2 mol/L。已知37℃时,平衡常数K=220,这时Hb·CO的浓度______(填<,>,=)Hb·O2浓度的0.02倍。
19.在10℃和2×105 Pa的条件下,反应aA(气)d D(气)+eE(气)建立平衡,再逐步增加体系的压强(温度保持不变),下表表示不同压强下的反应建立平衡时物质D的浓度:
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/(mol/L) | 0.085 | 0.20 | 0.44 |
(1)压强从2×105增加到5×105 Pa时,平衡向_____方向移动,理由是_______。
(2)压强从2×105增加到1×106 Pa时,平衡向_____方向移动,理由是_______,平衡之所以向该方向移动,这是由于____________。
四、简答题
20.对于可逆反应aA(气)+bB(气)cC(气)+dD(气)达到平衡时,各物质的物质的量浓度满足以下关系:![]() ,K为平衡常数。现有一反应:CO(气)+H2O(气)CO2(气)+H2(气)+Q,在85 ℃时,K=1。
,K为平衡常数。现有一反应:CO(气)+H2O(气)CO2(气)+H2(气)+Q,在85 ℃时,K=1。
(1)若升温至95 ℃时,达到平衡时K____1(填 <,>,=)。
(2)85 ℃时,固定容积的密闭容器中,放入混合物,起始浓度[CO]=0.01 mol/L,[H2O]=0.03 mol/L,[CO2]=0.01 mol/L,[H2]=0.05 mol/L,则反应开始时,H2O的消耗速率比生成速率_____(填大,小或不能确定)。
(3)保持温度,容器的体积不变,若往容器中充入适量的H2S气体,则重新达到平衡时,CO的反应速率比充H2S之前(填增大或减小)理由是_______________。
21.下表数据是在某温度下,金属镁和镍分别在O2中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间t/n | 1 | 4 | 9 | 16 | 25 |
| MgO层厚y/nm | 0.05 a | 0.20 a | 0.45 a | 0.80 a | 1.25 a |
| NiO层厚y’/nm | b | 2 b | 3 b | 4 b | 5 b |
注:a和b均为与温度有关的常数。
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是_________。
(2)金属氧化膜的膜厚y跟时间t所呈现的关系是(填直线型,抛物线型,对数或双曲线等类型):MgO氧化膜厚y属______型,NiO氧化膜厚y’属______型。
(3)Mg和Ni比较,哪一种金属更具有耐腐蚀性______,其理由是______________。
22.在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通。容器中发生以下反应:N2+3H22NH3+Q,若达到平衡后,测得混合气体的体积为7体积。据此回答以下问题:
(1)保持上述反应的温度不变,假设a,b,c分别代表初始加入的N2,H2和NH3的体积,如果反应达到平衡时,各物质的百分含量与上述平衡完全相同,那么:
①若a=1,c=2,则b=_____,在此情况下,反应开始时将向______方向进行;
②若需规定起始时,反应向逆方向进行,则C的体积范围是________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是________。
五、计算题
23.“为了除去工业废气中的SO2,可将SO2转化为(NH4)2SO4。据有关资料介绍,摘录如下:
初步处理的废气中含0.2%SO2,10%的O2(都是体积分数),在400 ℃时,以5 m3/h的速度通过V2O5触媒层,然后以流量25 L/h的NH3混合,再喷入流量为2 908 g/h的水,此时气体温度迅速从400 ℃下降至200 ℃,在热的结晶装置中得到(NH4)2SO4晶体。”据此资料回答下列问题:
(1)按反应理论值,SO2和O2的物质的量之比为2∶1。经过初步处理的废气中SO2与O2的物质的量的比值为______,采用这种比值的原因是________________________。
(2)进行冷却后的原因是_______________________。
(3)若将SO2全部转化SO3,SO3全部转化为(NH4)2SO4,则资料中NH3 每小时通入量至少应是______L,由此可得出NH3的利用率为________。
24.在390 ℃,3.03×105 Pa下,以CO和H2为原料合成CH3OH,存在下列平衡:CO(气)+H2(气) CH3OH(气),当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的含量都有影响。
(1)以m表示H2和CO的物质的量之比,(即![]() ),a表示CO的转化率,y为平衡时混合物中CH3OH的体积分数,试推断m,a,y三者的关系。
),a表示CO的转化率,y为平衡时混合物中CH3OH的体积分数,试推断m,a,y三者的关系。
(2)下表列出m=1,2,3,4时的一部分实验数据,试填出格中 a与y之值:
| m | 1 | 2 | 3 | 4 |
| a | 0.25 | 0.45 | ||
| y | 19.35% | 16.35% |
(3)根据以上计算数据讨论:反应物比例对平衡混合物中CH3OH含量的影响,并选择一最佳比例。
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 |
| B | C | A | A | B |
二、多项选择题
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | A | AB | D | AC | A | CD | BD | C | C |
三、填空题
16.7分。放热;>;(1)增加,增加;
(2)减小,减小;(3)不变
17.2分。加液氨后,使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,使反应:NH3+HClOH2O+NH2Cl的平衡向左移动,补充消耗的HClO,所以延长了液氯杀菌的时间。
18.4分。(1)![]() ;(2)大于。
;(2)大于。
19.5分。(1)逆;D的浓度增大的倍数(2.4倍)小于压强增大的倍数(2.5倍)。
(2)正;D的浓度增大的倍数大于压强增大的倍数;在该条件下,生成物质至少有一种变为液态或固态。
四、简答题
20.4分。(1)K<1;(2)小;(3)增大;H2S气体在850℃的建立如下平衡:
H2SH2+S,增大了反应体系中H2的浓度,使CO和H2O的反应平衡向左移动,[CO]浓度增大,故建立新平衡时,CO的反应速率增大。
21.6分。(1)反应速率可以用反应物的消耗速率,也可以用产物的生成速率来表示。
(2)直线型(y=0.005at);抛物线型(y’=![]() )。
)。
(3)Ni;它的腐蚀速率随时间的增长比镁慢。
22.4分。(1)由题可知,该反应在恒温,恒压下进行;只要起始时加入物质的量 v(H2)∶v(N2)=6∶2就可达到同一平衡状态。2体积NH3与1体积N2和3体积H2相当,则b=3。因反应前为8体积,反应后为7体积,总体积减少为1,由计算可知,平衡时氨的体积为1体积。现c=2,NH3必须减少,所以平衡向逆反应方向移动。
若需反应开始时即向逆反应方向进行,则氨的体积必须大于1,1体积N2,3体积H2相当于2体积NH3,所以c的最大值为4,则c值的范围为1<c≤4。
(2)若需控制平衡后混合气体的体积为6.5体积,小于原平衡后的体积(6.5<7),上述平衡向缩小气体体积的方向移动,即该反应向放热反应方向移动,所以采取降温措施。
五、计算题。
23.(1)1∶50;增大O2的浓度,提高SO2的转化率。(2)降温有利于生成(NH4)2SO4,高温时(NH4)2SO4会分解。
(3)v(NH3)∶v(SO2)=2∶1时,NH3与SO2可全部转化为(NH4)2SO4。
废气中每小时排出SO2:1000 L/m3×5 m3/h×0.2%=10 L/h,
则每小时通入NH3的量为20 L/h。
NH3的利用率=![]() 。
。
24.(1)设通入H2的物质的量为m,CO为1,
CO+2H2CH3OH
起始物质的量 1 m 0
转化物质的量 a 2a a
平衡物质的量 1-a m-2a 3
∴![]() 。
。
(2)m=1,a=0.25时,y=16.67%;
m=2,a=0.45时,y=21.43 %;
m=3,y=19.35 %时,a=0.558;
m=4,y=16.35 %时,a=0.493。
(3)由以上数据可以看出,m值小时,CO的转化率低,CH3OH的含量也低;m值较大时,CO的转化率高,但由于含有较多的H2,CH3OH的含量仍较低