高二化学提高测试4
一、填空题(本大题共45分,每小题有1~2个选项符合题意)
1.12g金属混合物跟足量稀硫酸反应,产生氢气0.5g,可能的金属混合物是( )
A. Mg和Al B. Mg和Cu C. Cu和Al D. Cu和Fe
2.氯化镁的溶液中含有氯化铁杂质。若要制得纯净的氯化镁,可向溶液中加入( )
A.MgO B. NaOH C. MgCO3 D. 金属镁
3.只用胶头滴管和试管,不用其它试剂就可以区别下列溶液(浓度均为0.1mol/L)的是( )
A.CaCl2和Na2CO3 B. 稀H2SO4和Na2CO3
C. Ba(OH)2和Na2CO3 D. NaAlO2和盐酸
4.实验室中将Fe放入FeSO4溶液中,能防止Fe2+被氧化。含铁的FeSO4溶液在放置过程中,Fe2+的物质的量浓度(不考虑溶剂的挥发)( )
A. 增加 B. 减小 C. 不变 D. 无法确定
5.某单质X能从盐的溶液中置换出单质Y,由此可知( )
A.当X和Y都是金属时,X一定比Y活泼
B.当X和Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y可能是金属,也可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
6.硝酸亚铁溶液呈浅绿色,在此溶液中滴加浓盐酸,下列叙述正确的是( )
A.溶液的颜色逐渐变浅
B.溶液的浅绿色逐渐变深
C.溶液的颜色由浅绿色变成棕黄色
D.溶液的颜色无明显变化
7.下列各组离子,可以在同一溶液中大量共存的是( )
A.Na+、Fe2+、H+、MnO4- B. Fe2+、H+、Cl-、AlO2-
C.Fe2+、K+、NO3-、S2- D. Fe2+、Al3+、Cl-、NO3-
8.某稀硝酸能与4.8 gCu恰好完全反应,同量的此稀硝酸在和Fe反应同样生成NO时,最多消耗Fe为( )
A. 4.2 g B. 0.075 mol C. 2.8 g D. 0.05 mol
9.把等物质的量的CuSO4、FeCl3和Zn置于水中,充分反应后,反应容器中所得混合物除SO42-、Cl-外,还有( )
A. Zn2+、Cu、Fe2+ B. Zn2+、Cu2+、Fe2+
C. Zn2+、Cu2+、Fe2+、Fe D. Zn2+、Cu2+、Fe2+、Cu
10.由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则此混合物中FeO、Fe3O4和Fe2O3的物质的量之比不可能是( )
A.1∶1∶2 B. 2∶1∶2 C. 1∶2∶2 D. 1∶3∶1
11.在天平两端各放一等质量的烧杯,分别注入同浓度同体积的足量盐酸,在一只烧杯中加入一定量的镁,另一只烧杯中加入等质量的铜铝合金,反应完全后,天平仍平衡,合金中铜和铝的质量比为( )
A. 1∶2 B. 1∶3 C.2∶3 D. 3∶4
12.由铜、锌和稀硫酸组成的原电池工作时电解质溶液的pH值怎样变化( )
A.不变 B. 先变小后变大 C. 逐渐变大 D. 逐渐变小
13.下列实验中铁的锈蚀最严重的是( )
A. 铁片放入蒸馏水中
B. 磨损的铁片放入溶有CO2的水中
C. 白铁片放入溶有CO2的水中
D.磨损的马口铁放入溶有CO2的水中
14.为了除去食盐水中的Ca2+、Mg2+、SO42-,有以下操作步骤:①过滤 ②加入稍过量的Na2CO3和NaOH溶液 ③加入稍过量的Ba(OH)2溶液 ④加入盐酸调pH值至中性。其操作程序正确的是( )
A.①②③④ B.③②①④ C.③②④① D.②③①④
15.用含硫量较高的生铁来炼钢时,应采取的措施是( )
A. 使用较多的生石灰 B.加入较多的焦炭
C. 加入较多的硅铁 D.掺入含磷较高的废钢
二、填空题(40分)
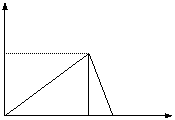 16.向20 mL某物质的量浓度的AlCl3溶液中滴加
沉淀(g)
16.向20 mL某物质的量浓度的AlCl3溶液中滴加
沉淀(g)
2 mol/L NaOH溶液时,生成沉淀的质量与NaOH溶
液体积的关系如右图所示。 0.78g A
(1)点Y处加入 mL NaOH溶液。
(2)原AlCl3溶液的物质的量浓度为 。
(3)当加入5mLNaOH溶液时,产生沉淀量为 g。 B
(4)图中B点表示 。 Y V(NaOH)mL
17.现有含Ag+、Mg2+、Al3+、K+的稀溶液,欲把上述离子一一分开,可使用的试剂只能在NaOH、NaCl、HCl中选择,每种试剂只用一次,不能重复,合理的实验步骤有三步,第一步是 ;第二步是 ;第三步是 。
18.已知FeCl3溶液可使淀粉KI溶液变蓝。判断Fe2+、Cl2、Fe3+、I2、I-、Cl-六种微粒中,氧化性最强的是 ;还原性最强的是 ,作为判断依据的离子方程式是 。
19.一定条件下,普通铁粉和水蒸气反应可得到铁的氧化物,该氧化物又可以经过此反应的逆反应生成颗粒很小的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热会燃烧,俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
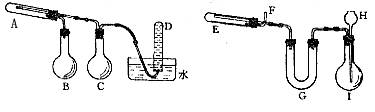
填写下列空白:
(1)实验进行时,试管A中应加入的试剂是 。
烧瓶B的作用是 。
烧瓶C的作用是 。
试管D中收集到的物质是 。
(2)实验时,U型管G中加入的试剂是 。
H中应加入 。
(3)两套装置中,需加热的仪器是(填对应字母) 。
(4)E中反应的化学方程式为 ;为了安全,在E中反应前,在F出口必须 。
20.砖瓦是用含铁元素等杂质的粒土隔绝空气烧制而成的,当烧窑作业临近结束时,若用淋洒水的办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色。若用捅开窑顶自然冷却的办法,砖就变成了红色。
(1)从化学角度看,砖瓦呈红色的原因是 。
(2)现有一块红砖,实验台上有浓硫酸、3mol/L的盐酸、0.1mol/L硫氰化钾溶液、0.1mol/L氯化铁溶液、0.001mol/L氢氧化钠溶液、蒸馏水等试剂,请选用中学化学常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁。(简述实验步骤、所用仪器、产生现象、所得结论)
。
21.下列五个图中,横坐标为向某溶液中加入某物质的量,纵坐标为生成沉淀的量;从A~E中选择符合表中各题要求的序号填在表中。
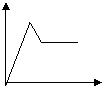 | 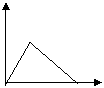 |  | 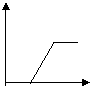 | 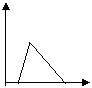 |
A B C D E
| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通过量CO2 | |
| AlCl3溶液 | 通过量NH3 | |
| 含少量NaOH的NaAlO2溶液 | 通过量CO2 | |
| 含少量NaOH的NaAlO2溶液 | 逐滴加稀盐酸 | |
| MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | |
| NaOH溶液 | 逐滴加AlCl3溶液至过量 |
22.水的硬度表示方法是:将水中的Ca2+、Mg2+折算成CaO的质量,1L水含10 mg CaO为1°。测知5000 kg某净化后的天然水煮沸后冷却得237 g沉淀,冷却水中含MgSO4为840 g,含CaCl2为777 g。将沉淀溶于盐酸得33.6 L CO2(标准状况下)。此天然水的硬度大约是 。
23.我国在春秋战国时期就懂得将白口铁经退火处理得相当于铸钢的物器(如锋利的刀剑),这一技术要比欧洲早近千年。白口铁退火热处理的主要作用是 。
三、计算题(15分)
24.铝粉与过氧化钠的混合物放入烧杯中加足量水,当反应停止后,变成澄清溶液,测得混合物总质量减少3.5g,再向所得澄清溶液中滴加3.5mol/L的盐酸200mL时,原澄清溶液先无明显现象,后出现白色沉淀,最后又恰好溶解。求原混合物中铝和过氧化钠各多少克?
25.已知:2Fe2+ + Br2 = 2Fe3+ + 2Br-。向100 mL FeBr2 溶液中缓慢通入2.24 L Cl2 (标准状况下),反应结束后溶液中有1/3的Br-被氧化成Br2 。求原FeBr2溶液的物质的量浓度。
参考答案
一、选择题
1.BC 提示:反应产生0.5 g氢气, 则有0.5 mol 电子转移,即金属混合物的平均摩尔电子质量为24,Mg的摩尔电子质量为12,Al的摩尔电子质量为9,Fe的摩尔电子质量为28,Cu与盐酸不反应,其摩尔电子质量看作无穷大。要得平均值24,两组分的摩尔电子质量必然是一个大于24,另一个小于24,或二者均为24。所以应选BC
2. AC
3. BD
4. A
5. AC 提示: (C选项)当X是金属时,Y可以是非金属氢气,所用盐溶液是NaHSO4溶液。
6. C
7. D
8. AB 提示:铜与稀硝酸的反应为:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O,铁与硝酸反应时,要使耗铁量最大,则得二价铁,即Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O,Fe + 2Fe3+ = 3Fe2+,总反应:3Fe + 8HNO3 = 3Fe(NO3)2 + 2NO↑ + 4H2O。所以同量的稀硝酸消耗同物质的量的铜和铁,铁的物质的量为4.8÷64=0.075 mol,质量为 0.075 mol×56 g/mol = 4.2 g。
9. D 提示:等物质的量的CuSO4、FeCl3和Zn置于水中,首先发生的反应为: 2Fe3+ + Zn = Zn2+ + 2Fe2+,反应后Zn有剩余,剩余的Zn继续与溶液中的Cu2+反应:Zn + Cu2+=Zn2+ + Cu, Zn量不足,Cu2+有剩余。
10. BD 提示:FeO中铁元素与氧元素的质量比为7∶2,Fe3O4中铁元素与氧元素的质量比为21∶8,Fe2O3中铁元素与氧元素的质量比为7∶3,混合物中铁元素与氧元素的质量比为21∶8,所以,混合物中Fe3O4的含量是任意的,只要FeO和Fe2O3的物质的量之比为1∶2即可。
11. B
12. C
13. D
14. B
15. A
二、填空题
16.(1)15 (2)0.5mol/L (3)0.26 (4)全为AlO2-
17.加入NaCl,得AgCl沉淀,分离出Ag+;加入足量NaOH,得Mg(OH)2沉淀,分离出Mg2+;加入适量HCl,得Al(OH)3沉淀,分离出Al3+。
18. Cl2 ; I- ; 2Fe3+ + 2I- = 2Fe2+ + I2 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
19.(1)普通铁粉 制备水蒸气 安全瓶,防倒吸 氢气(含少量水蒸气)
(2)碱石灰 盐酸
(3)A、B、E
(4)Fe3O4 + 4H2 ==== 3Fe + 4H2O 检验氢气的纯度
20.(1)捅开窑顶,空气进入窑内,铁元素被氧化成Fe2O3而呈红色
(2)砸碎红砖,取少量放入研钵内,研成粉末;将粉末放入试管中,向其中加入过量的3 mol/L盐酸;振荡,充分反应后静置,向上层清液中滴入几滴KSCN溶液;若呈血红色则证明有三价铁存在。
21.
| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通过量CO2 | B |
| AlCl3溶液 | 通过量NH3 | C |
| 含少量NaOH的NaAlO2溶液 | 通过量CO2 | D |
| 含少量NaOH的NaAlO2溶液 | 逐滴加稀盐酸 | E |
| MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | A |
| NaOH溶液 | 逐滴加AlCl3溶液至过量 | D |
22.19°
23.适当降低了含碳量
三、计算题
24.铝2.7 g 过氧化钠15.6 g
提示:设原混合物中过氧化钠的的物质的量为x,铝的物质的量为y
已知 m(H2) + m(O2)=3.5g n(HCl)=0.2L×3.5mol/L=0.7mol
2Na2O2 + 2H2O = 4NaOH + O2↑ 2Al + 2NaOH + 2H2O = 2NaAlO2 +3H2↑
2 mol 1 mol 2 mol 3 mol
x x/2 y 1.5y
![]() ∴ x/2×32g/mol + 1.5y×2g/mol=3.5g
①
∴ x/2×32g/mol + 1.5y×2g/mol=3.5g
①
∵ n(Cl-)=n(NaOH) + 3n(AlCl3)= n(Na) + 3n(Al)
![]() ∴ 2x + 3y
= 0.7
②
∴ 2x + 3y
= 0.7
②
由①和②得:x=0.2 mol y=o.1 mol
即:铝的质量为0.1 mol×27 g/mol=2.7 g,过氧化钠的质量为0.2 mol×78 g/mol=15.6 g。
25.1.2 mol/L
提示:
设原FeBr2的物质的量浓度为x
n(Cl2)= 2.24/22.4=0.1 mol
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 2Br- + Cl2 = Br2 + 2Cl-
2mol 1mol 2mol 1mol
0.1x 0.1x/2
![]()
![]()
∴ ![]() 得x=1.2 mol/L
得x=1.2 mol/L
∴ 0.5x=0.6
x=1.2mol/L