高二化学提高测试5
一、选择题
1.下列混合气体经点燃反应后,得到纯净物的是( )
A.质量比为4︰7的氧气和一氧化碳;
B.体积比为5︰2的空气和氧气;
C.物质的量之比为2︰1的氢气和氧气;
D.分子个数比为1︰2的甲烷和氧气。
2.根据碳是四价、氧是二价,氢是一价,氮是三价的原则,可能成立的分子式是( )
A.C3H8O B.C7H15O C.C4H4 D.C4H4NO
3.下列各组烃的混合物,只要总质量一定,无论它们按何种比例混合,完全燃烧后生成CO2和H2O都是恒量的是( )
A.C2H2、C2H4 B.C2H4、C3H6 C.C3H8、C3H6 D.C6H6、C2H2
4.有标准状况下的乙烯和乙炔组成的混合气体a L,完全燃烧消耗氧气b L,生成水w g和CO2 d L(各气体体积均在标准状况下测得),要计算混合烃乙烯与乙炔的体积比,下列叙述中,不正确的是( )
A.至少需要a、b、d、w四个数据中的两个
B.由a与b两个数据无法求算乙烯和乙炔的体积比
C.混合气体中乙烯和乙炔的体积比为(2b-5a)︰(6a-2b)
D.混合气体中乙烯和乙炔的体积比为(18d-w)︰(w-9d)
5.实验测得乙烯与氧气混合气体的密度是氢气的14.5倍,可知其中乙烯的质量分数是( )。
A.25.0% B.27.6% C.74.2% D.75.0%
6.某气态烃0.5 mol可与1 mol氯化氢完全加成,生成物可与3 mol氯气完全取代,取代后的有机产物分子中没有氢原子,则该气态烃可能为下列中的( )
A.乙烷 B.乙烯 C.丙炔 D.2-甲基丙烯
7.120 ℃ 时,1体积某烃和4体积O2混合,完全燃烧后恢复到原来的温度和压强时,体积不变。该烃分子式中所含的碳原子不可能是( )
A.1 B.2 C.3 D.4
8.CaC2和MgC2都是离子化合物,下列叙述正确的是( )
①CaC2和MgC2都能跟水反应生成乙炔
②CaC2在水中以Ca2+和![]() -形式存在
-形式存在
③![]() 的电子式为[∶C┆┆C∶]2-
的电子式为[∶C┆┆C∶]2-
④MgC2熔点低,可能在100 ℃以下
A.①② B.②③ C.①③ D.②④
9.两种气态烃以任意比例混合,在105 ℃时,1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是( )
①CH4、C2H4 ②CH4、C3H6 ③C2H4、C3H4 ④C2H2、C3H6
A.只有② B.②④ C.①③ D.②③④
10.已知分子式为C10H14的分子不能使溴水裉色,但可使酸化KMnO4溶液褪色,它的分子结构中只含一个烷基,它与液溴在还原铁粉存在的条件下,反应生成了一溴代物结构有12种,则此烷基的结构有( )
A.2种 B.3种 C.4种 D.5种
11.在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需要117 kJ/mol ~ 125 kJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,反应热为23.4 kJ/mol,以上事实表明( )
A.1,3-环己二烯加氢是吸热反应
B.1,3-环己二烯比苯稳定
 C.苯加氢生成环己烷是吸热反应
C.苯加氢生成环己烷是吸热反应
D.苯比1,3-环己二烯稳定。
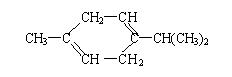
![]() 12.分子式为C10H16的某有机物的结构简式为
12.分子式为C10H16的某有机物的结构简式为
还可简写为 。下列有机物中,与上述有机物互为同分异构体的是( )
A. B.
C. D.
13.m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应进行到一定程度时,生成p mol C2H4,将反应后的混合气体完全燃烧,生成CO2和H2O。所需要氧气的物质的量是( )
A.(3m+n)mol B.(5m/2+n/2-3p) mol C.(3m+n+2p) mol D.(5m/2+n/2) mol
14.下列所述情况:①城市生活污水的任意排放;②农业生产中农药、化肥使用不当;③海上油轮石油泄漏;④工业生产中废液、废渣、废气的排放,可能引起水污染的是( )。
A.只有①③ B.只有①④ C.只有②④ D.①②③④
二.填空题
15.1 mol CH2=C(CH3)—CH═CH2和1 mol Br2完全加成,试写出产物可能的结构简式 。
16.二甲苯苯环上的一溴代物共有6种,可用还原的方法制得3种二甲苯,它们的熔点分别列于下表:
| 6种溴二甲苯的熔点 | 234 ℃ | 206 ℃ | 213.8 ℃ | 204 ℃ | 214.5 ℃ | 205 ℃ |
| 对应还原的 二甲苯的熔点 | 13 ℃ | -54 ℃ | -27 ℃ | -54 ℃ | -27 ℃ | -54 ℃ |
由此推断熔点为234 ℃分子的结构简式为 ,溶点为-54℃的分子的结构简式为 。
17.A盐和碱石灰反应,微热时放出一种气体B,再经强热又放出一种气体C,同温同压下,气体B和C密度接近。余下的残渣中加入硝酸,又有一种气体D放出。气体D通过一种淡黄色的固体可得到一种气体E。
(1)写出有关物质的化学式:A ;B ;C ;
(2)气体D转变为E的化学方程式 。
18.已知某混合气体中各成分的体积分数为CH4 80%、C2H4 15.0%和 C2H6 5.00%。请计算0.500 mol该混合气体的质量和标准状况下的密度(g/L)
19.CH4在一定条件下催化氧化可以生成C2H4、C2H6(水和其他反应产物忽略不计)。取一定质量的CH4经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780 g/L。已知反应中CH4消耗20.0%,计算混合气体中C2H4的体积分数。(本题计算过程中请保留3位有效数字)
20.苯环上原有的取代基对新取代导入苯环上的取代基的位置有一定的影响,其规律是:
(1)苯环上新导入取代基所占的位置主要决定于原有取代基的性质。
(2)可以把原有取代基分成两类:第一类取代基主要使新导入取代基进入苯环的邻位和对位如-OH,-CH3(或烃基)、-Cl、-Br、-O-COR等,第二类取代基主要使新导入的取代基进入苯环的间位,例如:-NO2、-SO3H、-CHO等。
请写出下面反应流程中第②、④、⑤三步反应的化学方程式
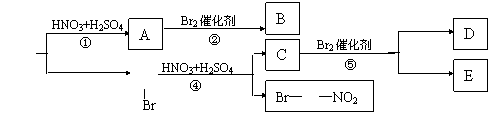 |
21.某种ABS工程树脂,由丙烯腈(CH2═CHCN,符号A)、1,3-丁二烯(CH2═CH—CH═CH2,符号B)和苯乙烯(—CH═CH2,符号S)按一定配比共聚而得。
(1)A、B和S三种单体中,碳氢比(C︰H)值最小的单体是 。
(2)经元素分析可知该ABS样品的组成为CaHbNc(a, b, c为正整数)则原料中A和B的物质的量之比是 。(用a, b, c表示)
参考答案
1.A、C
解析:4/32︰7/28=1︰2 ∵2CO+O2=2CO2 ∴A为纯净物。
B选项中为空气,∴肯定为混合物;
C中氢和氧反应的物质的量比为2︰1 ,∴也为纯净物。
CH4燃烧产物为H2O和CO2,∴为混合物。
2.A、C
解析:只有化合物分子中所有元素化合价的总数为偶数时,才有可能符合化合价代数和为零。
3.B、D
解析:总质量一定无论以何种比例混合,完全燃烧生成CO2和H2O为恒量时,必须是最简式相同的。B.D选项的烃最简式都相同。
4.B、D
解析:四个数据a、b、d、w中若只知道其中任何一个都是无法求出乙烯和乙炔的体积比。若给出的数据是a、d两个,因a、d是等价的,即不论什么情况下,必须d=2a成立。若以d、w计算,设乙烯、乙炔的体积分别为m、n,则:
(2m+n)/22.4=w/18 m=(11.2w-9d)/18
2m+2n=d n=(18d-11.2w)/18
m/n=(11.2w-9d)/(18d-11.2w)
5.D 6.C 7.D 8.C 9.B 10.C 11.D 12.A、C 13.D 14.D
15.CH2Br-C(CH3)Br-CH═CH2, CH2=C(CH3)-CHBr-CH2Br,
CH2Br-C(CH3)═CH-CH2Br
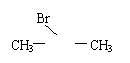 | |||
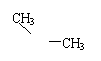 |
16.
17.(1)A:CH3COONH4 B:NH3 C:CH4
(2)2CO2+2Na2O2═2Na2CO3+O2
18.9.25 g;0.826 g/L
19.4.44%
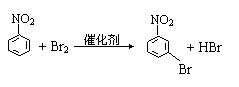 20.
②、④、⑤反应的化学方程式为:
20.
②、④、⑤反应的化学方程式为:
②
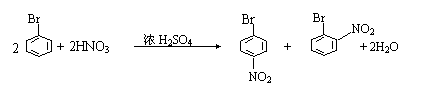 |
④
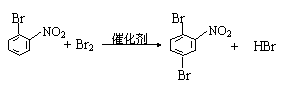 |
⑤
21.(1)1,3-丁二烯
(2)c︰[(b-a)/2][或2c︰(b-a)]
解析:3种单体中,只有丙烯腈(C3H3N)含N。只有丁二烯C4H6的碳氢比小于1。因此b比a多出2个H原子即为1个丁二烯分子。