高二化学同步测试 乙炔 炔烃
一、选择题
1.下列等物质的量混合的气体,其含碳元素的质量分数比乙烯高的是 ( )
A.甲烷和丙烷 B.己烷和丁烷
C.乙炔和丙烯 D.乙烷和丙烯
2.某气态烃0.5mol与1molHCl完全加成,加成后产物分子上的氢原子又可被3molCl2取代,则此气态烃可能是 ( )
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
3.某混合气体由两种气态烃组成,取2.24L该混合气体完全燃烧后,得到4.48L二氧化碳和3.6g水,则两种气态烃可能是 ( )
A.CH4和C3H8 B.CH4和C3H4 C.C2H4和C3H6 D. C2H2和C2H6
4.有amL3种气态烃的混合物,与足量的氧气点燃爆炸后,恢复到原来的状况(常温常压)体积缩小2amL,则这3种烃不可能是 ( )
A.CH4,C2H4,C3H4 B.C2H6,C3H6,C4H6 C.C2H2,C2H6,C3H8 D.CH4,C2H6,C2H2
5.相同条件下,乙烯和乙炔的混合气体xL,完全燃烧消耗O2yL。则原混合气体中乙烯和乙炔的体积比为 ( )
A. ![]() B`
B` ![]() C.
C. ![]() D.
D. ![]()
6.通式为CnH2n—2的一种气态烃,完全燃烧后生成的CO2和H2O的物质的量之比为4 :3,这种烃的链状同分异构体有 ( )
A.5种 B.4种 C.3种 D.2种
7.含有一个三键的炔烃,加氢后产物的结构式如下:
![]() 此炔烃可能的结构式有 ( )
此炔烃可能的结构式有 ( )
A.1种 B. 2种 C.3种 D.4种
8.某烃和溴水反应后的产物为2,2,3,3-四溴丁烷,则该烃的同分异构体为 ( )
A. 1-丁炔 B.2-丁炔 C. 1,3-丁二烯 D. 1-丁烯
9.下列说法正确的是 ( )
A. 丙炔分子中三个碳原子有可能位于同一直线上
B. 乙炔分子中碳碳间的三个共价键性质完全相同
C. 分子组成符合CnH2n—2通式的链烃,一定是炔烃
D. 在所有炔烃中,乙炔所含碳元素的质量分数最高
10.下列各组中的两种烃以体积比为1 :1组成的混合气体,在O2中充分燃烧后,生成的CO2和H2O(气)的体积比亦为1 :1,则这两种烃可能是 ( )
A.CH4 和 C2H4 B.C2H4和C3H6 C.C2H4和C2H2 D.C2H6和C4H6
11.某烃x催化加氢后,转化为碳氢原子个数比为1:2的另一种烃y,2.8g y吸收6.4g溴转化为溴代烷烃,则烃x的结构简式可能是 ( )
A ![]() B.
B. ![]()
C.CH2=CH-CH=CH2 D. ![]()
12.在一定条件下,将4gX、Y、Z三种炔烃所组成的混合气,在催化剂存在和加热的条件下,与足量的H2发生加成反应。可生成4.4g对应的三种烷烃。则所得的烷烃中一定含有 ( )
A.戊烷 B.丁烷 C.丙烷 D.乙烷
13.燃烧某烃的混合气体,所产生的CO2的质量一定大于燃烧同质量丙烯所产生的CO2的质量,该混合气体是 ( )
A.丁烯、丙烷 B.乙炔、乙烯 C.乙炔、丙烷 D.乙烷、环丙烷
二、填空题
14.相同状况下,同体积的两种气态烃,完全燃烧后生成CO2的体积比为1 :2,生成水蒸气的体积比为2 :3,则这两种烃的可能组成是(写分子式) 。
15.电石中的碳化钙和水能完全反应:CaC2 + 2H2O→C2H2↑+ Ca(OH)2 使反应产生的气体排水,测量出水的体积,从而可测定电石中碳化钙的含量。
(1) 若用下列仪器和导管组装实验装置,如下图:
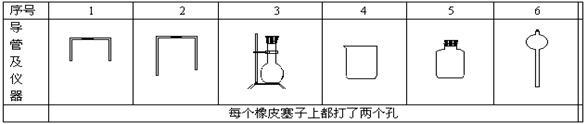
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器的序号)是
接 接 接 接 接 。
(2) 仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下至不产生气体时,关闭活塞。
正确的操作顺序是(用操作编号填写) 。
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有 杂质。
(4)若实验时称取的电石为1.60g,测量出排出水的体积后,拆算成标准状况下乙炔的体积为448mL,此电石中碳化钙的质量分数为 。
16、以石灰石、焦炭、食盐和水为原料制取聚氯乙烯,写出合成过程中有关的化学方程式(H2、Cl2可由电解饱和食盐水获得:2NaCl + 2H2O![]() 2NaOH + H2↑+Cl2↑).
2NaOH + H2↑+Cl2↑).
17.某烷烃A与炔烃B的混合气体共1mol,其质量为25.6g。取标准状况下的此混合气体6.72L,通入足量的溴水中,溴水增重4.8g,则A为 ,B为 。
三、计算题
18.含碳原子数均不大于4的炔烃和烯烃,在120℃、101Kpa时,将1L某气态炔烃与某气态烯烃的混合气体与14LO2(过量)混合,点燃充分反应后所得到的气体在相同条件下为15L,通过计算确定混合气中炔烃和烯烃的分子式,及它们的体积比。
答案:
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| C | C | BD | B | D | C | A | AC | AD | BD | AD | D | B |
14、CH4与C2H6 或 C2H4与C4H6
15.(1)6,3,1,5,2,4
(2)2,1,3,5,4
(3) 其他可与水反应生成气体的
(4) 80%
16、CaCO3![]() CaO +CO2↑ CaO +3C
CaO +CO2↑ CaO +3C![]() CaC2 + CO↑ CaC2
+2H2O→
CaC2 + CO↑ CaC2
+2H2O→![]() + Ca(OH)2
+ Ca(OH)2
2NaCl + 2H2O![]() 2NaOH + H2↑+Cl2↑ H2+Cl2
2NaOH + H2↑+Cl2↑ H2+Cl2
![]() 2HCl
2HCl ![]() +HCl
+HCl![]()
![]()
![]()
![]()
17.A CH4 B.C3H4
18.平均组成为CxH4
(1) 若烯烃、炔烃分子中氢原子都为4,则该混合烃由乙烯和乙炔组成,其体积比为任意比。
(2) 若烯烃分子中氢原子数大于4,则炔烃分子中氢原子数必小于4,必为乙炔,可能组成为
C2H2与C3H6 比值为1 :1或 C2H2与C4H8比值为2 :1