高二化学同步练习 氮和磷(二)
班级__________姓名__________学号___________
一、选择题(每小题只有一个选项符合题意)
1.利用下列方法,可以在实验室里从空气中制取氮气的是
A把空气液化, 然后分离出氮气B把空气缓缓通过加热了的铜网
C把空气缓缓通过加热了的镁粉D把空气通过装有氢氧化钠的洗气瓶
2.下列叙述正确的是
A.氮族元素的气态氢化物均难生成,且均不稳定B.氮族元素单质只有磷存在同素异形体
C.氮族元素的最高价氧化物对应的水化物均显强氧化性 D.氮族元素均存在可变化合价
3.有一种磷的结构式是![]() ,有关它的下列叙述不正确的是
,有关它的下列叙述不正确的是
A.它完全燃烧时的产物是P2O5 B.它不溶于水
C.它在常温下呈固态 D.它与白磷互为同分异构体
3.下列各项用途中,应用了N2不活泼性的是
A.N2和H2合成氨,制造氮肥 B.N2充入钨丝灯泡,使灯泡经久耐用
C.潜水员的呼吸面具中通入混有N2的O2 D. N2 可以做制冷剂
4.下列各组气态氢化物中,按稳定性由强到弱顺序排列正确的是
A.SiH3、PH3、H2S、HCl B.NH3、PH3、H2O、H2S
C.HF、H2O、NH3、PH3 D.AsH3、PH3、NH3、CH4
5.在氮的氧化物中,氮元素和氧元素的质量比是7∶12,则氮元素的化合价是
A.+4 B.+2 C.+3 D.+5
6.下列各组物质中,组内每种物质既有氧化性,又有还原性的是
A.NH3,N2,NO,NO2 B.NH3,NO,HNO3,N2O3
C.N2,NO,N2O5,N2O D.N2,NO2,NO,N2O3
7.除去NO2气体中的少量NH3,可以选用的试剂是
A.浓H2SO4 B.NaOH溶液 C.稀H2SO4 D.水
8.鉴别NO2和溴蒸气的方法正确的是
(1).用AgNO3溶液(2).用湿润的KI—淀粉试纸(3).用NaOH溶液(4).用蒸馏水
A.(1)(2) B. (2)(3) C. (2)(4) D. (1)(4)
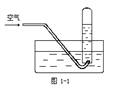 9.按图1-1进行实验,试管内装有12mL NO,然后间歇而缓慢地通入8 mLO2,下面有关实验最终状态的描述正确的是
9.按图1-1进行实验,试管内装有12mL NO,然后间歇而缓慢地通入8 mLO2,下面有关实验最终状态的描述正确的是
A.试管内气体呈红棕色 B.试管内气体为无色是NO
C.试管内气体为无色是O2 D.试管内液面高度上升,无气体剩余
10.某集气瓶呈红棕色,加入足量的水,盖上玻璃片振荡,得棕色溶 液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色.该气体可能是下列混和气中的
A.N2、NO2、Br2 B.NO2、NO、N2 C.NO2、O2、NO D.N2、O2、Br2
11.科学家用计算机模拟后确认,60个N原子可结合成N60分子。下列关于N60的叙述中正确的是
A. N60是一种新型的化合物 B. 一个N60分子中含有30个N2分子
C. N60和N2的性质完全相同 D. N60和N2混合形成的是混合物
12.常温下将盛有10mL![]() 和10mL
和10mL![]() 混合气体的试管倒立于水中,并向其中通入
混合气体的试管倒立于水中,并向其中通入![]() 一段时间后,试管内剩余2mL气体,则通入
一段时间后,试管内剩余2mL气体,则通入![]() 的体积为
的体积为
A. 8mL B. 8.5mL C. 10mL D. 12mL
13.将H2、N2、O2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(p)大小的关系,符合(原子量:H 1 N 14 O 16)
A.p(H2)>p(O2)>P(N2) B. p(O2)>P(N2)>p(H2)
C.p(H2)>P(N2)>p(O2) D. P(N2)>p(O2)>p(H2)
14.1999年曾报道合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是 A、N5+共有34个核外电子 B、N5+中氮原子之间以共用电子对结合
C、N5AsF6中As的化合价为+1 D、 N5AsF6中F的化合价为-1
二、填空题
15.有两种气体,一种能氧化氮气,一种能还原氮气.写出这两个反应的化学方程式:
(1)________________________________;(2)_________________________________.
16.在适当的温度和压力下,4体积某气态氢化物完全分解后,产生1体积的磷蒸气和6体积的氢气.由此可以推断该气态化合物的分子式为________;该分解反应的化学方程式为_____________________________________________.
17. 汽车尾气(含有CO、![]() 与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转化器”,它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使
与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转化器”,它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使![]() 的转化。
的转化。
(1)写出CO与NO反应的化学方程式_____________________。
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是__________。
(3)控制城市空气污染源的方法可以有_________。
a. 开发氢能源 b. 使用电动车 c. 植树造林 d. 戴呼吸面具
18.红磷在露置情况下久存往往表面发潮,这是由于红磷在空气中表面极缓慢地氧化,生成P2O5有吸水性,形成粘稠状液体所致,要得到干燥的红磷最好的办法是________.
A.加热使其挥发掉 B.水洗除去易溶的粘稠液体,立即干燥密闭保存
C.加石灰干燥后再水洗、过滤、干燥、密封保存
D.加还原剂使其还原为红磷,再干燥、密封
19.现有原子序数之和为51的五种短周期元素A、B、C、D、E。已知A单质在常温下为无色气体;B原子的最外层电子数比次外层多了3个;C和B属于同族元素;D的最高正价和负价的代数和为4,其氢化物的熔点在同主族元素的氢化物中最低,E元素的原子最外层电子数与其K层电子数相同。
写出它们的元素符号:A __ 、B 、C 、D 、E 。
三、计算题
20.计算题将V ml NO和NO2的混合气体通过足量水吸收后,得到 a ml 无色气体A ,将A与等体积O2混合,再通过水充分吸收后,收集到5 ml 无色气体B 。
试回答:(1)A、B各为何种气体? (2)A气体的体积是多少?
(3)V的取值是多少?