第一学期
高二化学期末试卷5
出卷人:朱英杰
(本试卷可能用到的原子量:H-1,C-12,O-16,S-32,Na-23,Al-27,Ba-137,Mg-24, Cl-35.5, Cu-64, N-14,Fe-56)
一、选择题[每题只有一个正确答案,每题2分,共20分]
今日化学学科正积极向一些与国民经济和社会生活关系密切的材料、能源、环境、
生命等学科渗透,使化学的作用与地位日益显著。下列1—7题就体现了化学知识
在上述领域的一些应用。
1.我国“九五”期间已建成投产和已开工兴建的核电站共有浙江、广东、辽宁、江苏等4座,这些电站的选址都在沿海岛屿,这主要是为了
A.考虑辐射安全 B.便于核废料处理
C.便于运输设备 D.减小可能的核泄漏所造成的影响
2.CO和NO都是汽车尾气里的有害气体,它们能缓慢的发生化学反应:2NO+2CO![]() N2+2CO2,
(正反应为吸热反应)对此反应,下列叙述正确的是
N2+2CO2,
(正反应为吸热反应)对此反应,下列叙述正确的是
A. 使用催化剂不能加快该化学反应的速率
B. 改变压强对该化学反应的速率没有影响
C. 汽车尾气在冬天比在夏天危害要大
D. 此反应不会受外界条件的影响
3.下列哪一种物质对大气污染气体如:Cl2、SO2、H2S、NO2都具有很好的吸收作用
A.KI溶液 B.NaHSO3溶液 C.氨水 D.FeCl2溶液
4.煤、石油、天然气和生物能资源的能量形成和转换过程基本上是
A.太阳辐射能→化学能→热能 B.太阳辐射能→机械能→电能
C.生物能→电能→化学能→热能 D.太阳辐射能→机械能→化学能
5.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是
A. Mg2+ B. Na+ C. Ca2+ D. Fe3+
6.下列新型无机非金属材料中常用于生产现代通讯材料的是
A. 氧化铝陶瓷 B.氮化硅陶瓷 C. 光导纤维 D. 复合材料
7.最近,有一种号称“世纪之星”的新材料问世,它指的是
A.钛合金材料 B.纳米材料 C.高分子材料 D.铝合金材料
8.能使合成氨反应进行程度增大的是
A. 升高温度 B. 使用催化剂
C. 降低压强 D. 及时分离出氨气
9.某强酸性溶液中含有大量Fe2+和Ba2+,该溶液可能含的阴离子是
A.NO3- B.SO42- C.Cl- D.CO32-
10.氮气可以用作保护气,是因为它
A. 沸点很低 B. 分子中键能很大,化学性质稳定
C. 比空气轻 D. 是双原子分子
二、选择题[本题包括15小题,每小题3分,共45分。每小题有一个或两个选项符合题意,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分]
11.下列说法正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
12. 0.03mol铜完全溶于硝酸,产生氮的氧化物(NO,NO2,N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是(讨论:2x+z=0.01,x=0,z=0.01;z=0,x=0.005)
A. 30 B. 46 C. 50 D. 66
13.下列各反应的化学方程式中,属于水解反应的是
A.HB.C.D.
14.今有甲、乙、丙三瓶等体积的新制氯水,浓度约为0.1mol/L,如果甲瓶中加入少量的NaHCO3,乙瓶中加入少量NaHSO3,丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO浓度的大小比较正确的是
A.甲>乙>丙 B.丙>甲>乙 C.甲>丙>乙 D.无法确定
15.
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A、等于p% B、大于p% C、小于p% D、无法判断
16. 等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
A、[M+]>[OH-]>[A-]>[H+] B、[M+]>[A-]>[H+]>[OH-]
C、[M+]>[A-]>[OH-]>[H+] D、[M+]+[H+]
=[OH-]+[A-]
17.Al3+ + 3AlO2-+ 6H2O =4Al(OH)3↓的离子方程式最适合下列的
A.向铝盐溶液中不断加入NaOH溶液
B.向NaOH溶液中不断加入铝盐溶液
C.向铝盐溶液中不断加入Na2CO3溶液
D.向铝盐溶液中不断加入NaHCO3溶液
18. 用水稀释0.1摩/升氨水时,溶液中随着水的增加而减小的是
A、c(OH-)/c(NH3·H2O) B、c(NH3·H2O)/ c(OH-)
C、c(H+)和c(OH-)的乘积 D、OH-的物质的量
19.电子计算器中用的纽扣式电池是银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:Zn+2OH-—2e=Zn(OH)2, Ag2O+H2O+2e=2Ag+2OH-,
总反应式为:Ag2O+H2O+Zn=Zn(OH)2+2Ag, 则下列叙述正确的是
A.电流由锌经外电路流向氧化银
B.溶液中 OH-向正极移动,K+、H+向负极移动
C.锌是负极,氧化银是正极
D.工作时,负极区溶液pH值减小,正极区pH值增大
20.只用试管和胶头滴管而不用其它试剂无法区分的一组试剂是
A.KOH溶液和AlCl3溶液 B.Na2CO3溶液和HCl溶液
C.稀硝酸溶液和氨水 D.盐酸和NaAlO2溶液
21.下列各化学反应的离子方程式中,有错误的是
A.氢氧化铝与盐酸反应 Al(OH)3 + 3H+=Al3+ + 3H2O
B.氧化铝溶于氢氧化钠溶液 Al2O3+ 2OH-=2AlO2-+ H2O
![]() C.溴化亚铁溶液中滴入过量氯水 2Br-+Cl2=Br2+2Cl-
C.溴化亚铁溶液中滴入过量氯水 2Br-+Cl2=Br2+2Cl-
D. 氯化铁溶液中通入硫化氢气体 2Fe3++S2-=2Fe2++S
22.下列各组反应中,无论反应物的量多少肯定能得到Al(OH)3的是
A.把CO2通入到NaAlO2溶液中 B.把NH3通入到硫酸铝溶液中
C.把Na投入到NaAlO2溶液中 D.把Ba(OH)2投入到明矾溶液中
23. 在某200mL溶液中含有MgCl2的浓度为2mol/L,AlCl3 3mol/L,若只将溶液中的Mg2+完全以Mg(OH)2的形式沉淀出来,至少应加入2mol/L的NaOH溶液
A. 2L B.1.8L C. 1.6L D. 2.2L
24. 1molX气体与 a molY气体在体积可变的密闭容器中发生如下反应,X(g)+aY(g) ![]() bZ(g),反应达到平衡后,测得X的转化率为50%。而且在同温同压下测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(g),反应达到平衡后,测得X的转化率为50%。而且在同温同压下测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a=1,b=1 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
25.常温下10mlpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7,(假设反应前后溶液的体积不变)则对反应后溶液的叙述正确的是
A. c(A-)=c(K+) B. c(H+)=c(OH-)<c(K+)<c(A-)
C. V总≤20ml D. V总≥20ml
三、填空题[共14分,第26题6分;第27题8分]
26.在某反应体系中共有As2S3、HNO3、NO、H2SO4、H3AsO4、H2O六种物质,已知As2S3是反应物之一。
(1) 写出并配平该反应的化学方程式 。
(2) 氧化产物是 ,氧化剂为 。
(3) 该反应电子转移的总数是 。
27.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数K的表达式是K= 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)能判断该反应是否达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O) d. c(CO2)=c(CO)
(4)某温度下,其平衡浓度符合:c(CO2)×c(H2)=c(CO)×c(H2O),则此时的温度为 ℃。
四、研究性实验:[共4分,每空2分]
 28.我校高二化学研究性学习小组为了探究金属材料的电化学腐蚀情况,做了如下的实验:将铁片和铜片焊接起来,再在两块金属焊缝处涂上含有酚酞试液的NaCl溶液(如图),隔了两天,请问可以观察到的现象是
。
28.我校高二化学研究性学习小组为了探究金属材料的电化学腐蚀情况,做了如下的实验:将铁片和铜片焊接起来,再在两块金属焊缝处涂上含有酚酞试液的NaCl溶液(如图),隔了两天,请问可以观察到的现象是
。
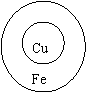 请您分析原因
。
请您分析原因
。
五、计算题[共17分,第29题7分,第30题10分]
29.将54.4g铁和氧化铁的混合粉末,投入足量的稀硫酸中充分反应后,收集到4.48LH2(标准状况下),在反应后的溶液中加入KSCN溶液,无现象。问原混合粉末中铁和氧化铁的质量各为多少? 反应后能得到硫酸亚铁的物质的量是多少?
30.工业尾气中的氮的氧化物(NO、NO2)是主要的大气污染之一。常用以下两种治理方法(已简化)。
(1) 氢氧化钠吸收法,反应原理如下:
2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO3+H2O
![]() (2)氨催化还原法,反应原理是: NOx+NH3 N2+H2O
(2)氨催化还原法,反应原理是: NOx+NH3 N2+H2O
现有一定量的含NO2和NO的硝酸工业尾气(不含其它气体),若用过量的NaOH 溶液吸收后,溶液中NaNO3与NaNO2的物质的量之比恰好与原尾气中NO和NO2 的物质的量之比相等。
①若用NOx表示该尾气中氮的氧化物的平均组成,则x的值为____。
②将1体积的该尾气用(2)的方法处理,至少消耗相同状况下的氨气_____ 体积。
![]()
![]()
![]()
![]() ③配平化学方程式: NOX+ NH3—— N2+ H2O
③配平化学方程式: NOX+ NH3—— N2+ H2O
[附加题:共5分,计入总分,但总分不超过100分]
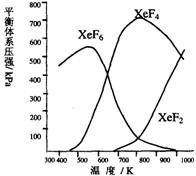
Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L Xe和1.225mol/L F2为始态得到的生成物在平衡体系内的分压与反应温度的关系。
1.应在什么温度下制备XeF2和XeF4?
2.Xe和F2生成XeF6和XeF4,哪个反应放热更多?简述理由。
3.为有效地制备XeF2,应在什么反应条件下为好?简述理由。
[解答]
1.温度为 K, K。
2. 的反应放热更多。理由是
。
3.反应条件是 。理由是
。
高二化学期末试卷答卷
一、选择题(每题只有一个正确答案,每题2分,共20分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | C | A | B | C | B | D | C | B |
二、多项选择题(本题包括15小题,每小题3分,共45分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | BC | C | C | B | CD | B | C | CD | C |
| 题号 | 21 | 22 | 23 | 24 | 25 |
| ||||
| 答案 | CD | AB | C | AD | A |
| ||||
三、填空题[共14分,第26题6分;第27题8分]
26. (1)写出并配平该反应的化学方程式 。
(2)氧化产物是 ,氧化剂为 。
(3)该反应电子转移的总数是 。
27.(1)该反应的化学平衡常数K的表达式是K=c(CO)*c(H2O)/c(CO2)*c(H2) 。
(2)该反应为 吸热 反应。(填“吸热”或“放热”)
(3)能判断该反应是否达到化学平衡状态的依据是 b,c 。
(4) 试判断此时的温度为 830 ℃。
四、研究性实验[共4分,每空2分]
28.可以观察到的现象是 。
请您分析原因 。
五、计算题[共17分,第29题7分,第30题10分]
29.
30.①则x的值为__7/4。
②至少消耗相同状况下的氨气____7/6_ 体积。
③配平化学方程式: 6NOX+4XNH3==(3+2X)N2+6XH2O
[附加题:共5分,计入总分,但总分不超过100分。请将解答写在左边题目下]
29. 学校化学兴趣小组为研究空气中的大气污染物SO2的吸收处理问题,计划将足量的SO2通入KOH和Ca(OH)2的混合稀溶液中,请在下图上表示出生成沉淀的物质的量(n)和通入的SO2体积(V)的曲线关系。
 n
n
V
高温下硫酸亚铁发生如下反应:2FeSO4![]() Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是D
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是D
A BaSO3和BaSO4 B BaS C BaSO3 D BaSO4
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5︰6,则甲、乙两烧杯中的反应情况可能分别是B
A 甲、乙中都是铝过量 B 甲中铝过量、乙中碱过量
C 甲中酸过量、乙中铝过量 D 甲中酸过量、乙中碱过量
在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2CO3的浓度都等于:D
A. 0.0075mol•L-1 B. 0.008mol•L-1
C. 0.075mol•L-1 D. 0.08mol•L-1
高二化学期末试卷答卷
一、选择题(每题只有一个正确答案,每题2分,共20分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
二、多项选择题(本题包括15小题,每小题3分,共45分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | 24 | 25 |
| ||||
| 答案 |
| |||||||||
三、填空题[共14分,第26题6分;第27题8分]
26. (1)写出并配平该反应的化学方程式 。
(2)氧化产物是 ,氧化剂为 。
(3)该反应电子转移的总数是 。
27.(1)该反应的化学平衡常数K的表达式是K= 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)能判断该反应是否达到化学平衡状态的依据是 。
(4) 试判断此时的温度为 ℃。
四、研究性实验[共4分,每格2分]
28.可以观察到的现象是 。
请您分析原因 。
五、计算题[共17分,第29题7分,第30题10分]
29.
30.①则x的值为____ 。
②至少消耗相同状况下的氨气_____ 体积。
![]()
![]()
![]()
![]() ③配平化学方程式: NOX+ NH3—— N2+ H2O
③配平化学方程式: NOX+ NH3—— N2+ H2O
[附加题:共5分,计入总分,但总分不超过100分。请将解答写在左边题目下]