高二化学热点内容专题训练
化学反应速率
1.在一定条件下,反应N2+3H2![]() 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A.V(H2)=0.03mol/L·min B.V(N2)=0.02mol/L·min
C.V(NH3)=0.17mol/L·min D.V(NH3)=0.01mol/L·min
2.下列四个数据都表示合成氨的反应速率,其中速率代表同一反应中的是
①V(N2)=0.3mol/L·min ②V(NH3)=0.9mol/L·min
③V(H2)=0.6mol/L·min ④V(H2)=0.0225mol/L·min
A.①② B.①③ C.③④ D.②④
3.工业上进行反应2SO2+O2![]() 2SO3+Q,使用催化剂的目的是
2SO3+Q,使用催化剂的目的是
A.扩大反应物的接触面 B.促使平衡向正反应方向移动
C.缩短达到平衡所需要的时间 D.提高SO2的转化率
4.下列因素会使化学反应速率加快的是
①增加反应物的物质的量 ②升高温度 ③缩小容器体积 ④加入生成物
A.①②④ B.②③ C.①②③ D.只有②
5.在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)若最初加入的A.B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
6.合成氨的反应为3H2+N2=2NH3,其反应速度可以用VH2、VN2、VNH3(摩/升·秒)表示,则正确的关系式是
(A)VH2=VN2=VNH3 (B)VN2=3VH2 (C)VNH3=3VH2/2 (D)VH2=3VN2
7.已知4NH3+5O2=4NO+6H2O,若反应速度分别用VNH3、VO2、VNO、VH2O(摩/升分)。则正确的关系是
(A)4VNH3/5=VO2 (B)5VO2/6=VH2O (C)2VNH3/3=VH2O (D)4VO2/5=VNO
8.反应4NH4+5O2=4NO+6H2O在5升的密闭容器中进行,半分钟后,NO增加了0.3摩,则此反应的反应速度(表示反应物的消耗速度或生成物的生成速度)为
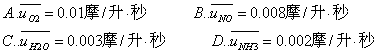
9.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
(A)碳酸钠固体 (B)乙酸钠固体 (C)硫酸钾固体 (D)硫酸铵固体
10.NO与CO都是汽车尾气里有害的物质,它们能缓慢地起反生成氮气和二氧化碳,对此反应,下列叙述正确的是( )
(A) 使用催化剂可以加快反应速率
(B) 其它条件不变,升温反应速率会加快
(C)其它条件不变,加压对反应速率没有影响
(D)外界任何条件怎样改变,均对此化学反应速率无影响
11.在一密闭容器中,盛有N2和H2,它们的起始浓度分别是1.5mol/L和4.5mol/L。一定条件下发生反应生成NH3,10秒钟后测得N2的浓度是1.4mol/L。则H2在10秒钟内的平均反应速率是( )
(A)0.1mol/(L·s) (B) 0.3mol/(L·s)
(C)0.01mol/(L·s) (D) 0.03mol/(L·s)
12.用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
(a)再加入30毫升3摩/升盐酸 (b)改用30毫升6摩/升盐酸
(c)改用3克粉末状大理石 (d)适当升高温度
( A )(a)(b)(d) ( B )(b)(c)(d) ( C )(a)(c)(d) ( D )(a)(b)(c)
13.在N2+3H2![]() 2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.45
mol/L·s,则所经历的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.45
mol/L·s,则所经历的时间是( )
(A)0.44s (B)1s (C)1.33s (D)1.2s
14.在相同温度下,下列化学反应速率最慢的是( )
(A)10mL 0.1mol/L Na2S2O3+10mL 0.1mol/L H2SO4
(B) 5mL 0.1mol/L Na2S2O3+5mL 0.1mol/L H2SO4
(C) 5mL 0.1mol/L Na2S2O3+5mL 0.05mol/L H2SO4
(D) 10mL 0.05mol/L Na2S2O3+10mL 0.05mol/L H2SO4
15.在其它条件不变时,设某物质在10℃时反应速率为3 mol/(L·s),每升高10℃,反应速率是原来的3倍,那么50℃时的反应速率是( )
(A)9 mol/(L·s) (B)27 mol/(L·s)
(C)81 mol/(L·s) (D)243 mol/(L·s)
16.对于可逆反应A(气)+2B(气)![]() 2C(气)+Q的平衡体系,下列说法错误的是( )
2C(气)+Q的平衡体系,下列说法错误的是( )
(A)使用催化剂,v正、v逆都改变,变化的倍数相同
(B)降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
(C)增大压强,正、逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数
(D)升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数
(E)扩大容器体积,容器内A、B、C物质的量都不变
17.一般都能使化学反应速率加快的方法是:( )
(a)升温;(b)改变生成物浓度;(c)增加反应物浓度;(d)加压
( A )(a)(b)和(c) ( B )(a)和(c) ( C )(b)和(d) ( D )全部
18.在某温度下,将0.64摩H2和0.64摩I2(蒸气)通入一个容积为10升的密闭容器里,经5分钟,当反应达到平衡时,测知容器中有1摩HI气体。用H2浓度的变化来表示这5分钟内的平均反应速率(摩/升·分)为( )
( A )0.1 ( B )0.05 ( C )0.02 ( D )0.01
19.反应4NH3(气)+5O2(气)= 4NO(气)+6H2O(气)在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
A.NO:0.001mol/L B.H2O:0.002mol/L
C.NH3:0.002mol/L D.O2:0.00125mol/L
20.某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。达平衡后[X2]为0.4mol/L,则该反应式为( )
(A)X2+2Y2![]() 2XY2 (B)2X2+Y2
2XY2 (B)2X2+Y2![]() 2X2Y
2X2Y
(C)3X2+Y2![]() 2X3Y (D)X2+3Y3
2X3Y (D)X2+3Y3![]() 2XY3
2XY3
21.把下列4种X的溶液分别加入4个盛有10mL 2mol/L盐酸的烧杯中,均加水稀到50mL,此时X和盐酸和缓地进行反应。其中反应速率最大的是( )
(A)20mL 3mol/LX的溶液 (B)20mL 2mol/L的溶液
(C)10ml 4mol/LX的溶液 (D)10mL 2mol/L的溶液
22.在一定条件下,1L密闭容器中装入2mol N2与足量H2反应,2min末时,测得N2为1mol。该反应的速度表示中,不正确的是( )
(A)![]() =0.5mol/L·min; (B)
=0.5mol/L·min; (B)![]() =1.5mol/L·min;
=1.5mol/L·min;
(C)![]() =1mol/L·min; (D)
=1mol/L·min; (D)![]() =1mol/L·min。
=1mol/L·min。
23.下列体系加压后,对化学反应速率没有影响的是( )
(A)2SO2+O2![]() 2SO3 (B)CO+H2O(g)
2SO3 (B)CO+H2O(g) ![]() CO2+H2
CO2+H2
(C)CO2+H2O![]() H2CO3 (D)H++OH-
H2CO3 (D)H++OH-![]() H2O
H2O
24.设C+CO2 ![]() 2CO-Q1,反应速度为v 1;N2+3H2
2CO-Q1,反应速度为v 1;N2+3H2![]() 2NH3+Q2,反应速度为v 2。当温度升高时,v 1和v 2的变化情况为( )
2NH3+Q2,反应速度为v 2。当温度升高时,v 1和v 2的变化情况为( )
(A)都增大 (B)都减小 (C)v 1增大v 2减小 (D)v 1减小v 2增大
25.在一定条件下,将A2和B2两种气体通入1L密闭容器中,反应按下式进行:
xA2+yB2 ![]() 2C(气),两秒种后反应速率如下
2C(气),两秒种后反应速率如下
VA2=0.4mol/(L·s) VB2=1.2 mol/(L·s) VC = 0.8mol/(L·s) 则该x和y的值分别为( )
(A)2和3 (B)3和2 (C)3和1 (D)1和3
化学反应速率相关知识点
1.化学反应速率概念:用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
(1)表示方法:v = △c/△t
(2)单位:mol/(L·s);mol/(L·min).
(3)相互关系:4NH3
+ 5O2 ![]() 4NO + 6H2O(g)
4NO + 6H2O(g)
v(NH3):v(O2): v(NO) : v(H2O) == 4:5:4:6
即以不同物质表示反应速率时与配平的化学方程式的系数成比例。
(4)活化分子、有效碰撞。
2. 影响化学反应速率的因素
(1) 内因:反应物本身的性质(如:硫在空气中和在氧气中燃烧的速率明显不同)。
(2) 外因:
(i)浓度:浓度越大,分子之间距离越短,分子之间碰撞机会增大,发生化学反应的几率加大,化学反应速率就快;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。增大反应物的浓度,正反应速率加快。
(ii)温度:温度越高,反应速率越快(正逆反应速率都加快)
(iii)压强:对于有气体参与的化学反应,通过改变容器体积而使压强变化的情况:
PV = nRT P = CRT 压强增大,浓度增大(反应物和生成物的浓度都增大正逆反应速率都增大,相反,依然。
(iv)催化剂:改变(增大或减小)化学反应速率(对于可逆反应使用催化剂可以同等程度地改变正逆反应速率)。
化学反应速率历届高考题
100毫升6摩/升H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,可向反应物中加入适量的( )
![]() A.碳酸钠固体
B.水 C.硫酸钾溶液
D.硫酸铵固体
A.碳酸钠固体
B.水 C.硫酸钾溶液
D.硫酸铵固体
反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.v (O2)=0.010mol/L·S B.v (NO)=0.008mol/L·S
C.v (H2O)=0.003mol/L·S D.v (NH3)=0.002mol/L·S
![]() )已知 4NH3(气)+5O2(气)
4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L·min]表示,则正确的关系是( )
)已知 4NH3(气)+5O2(气)
4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L·min]表示,则正确的关系是( )
![]() A.4/5V(NH3)=V(O2) B.5/6V(O2)=V(H2O)
A.4/5V(NH3)=V(O2) B.5/6V(O2)=V(H2O)
C.3/2V(NH3)=V(H2O) D.4/5V(O2)=V(NO)
反应 4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在2L的 密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol/L B.H2O:0.002mol/L
C.NH3:0.002mol/L D.O2:0.00125mol/L
已知反应A+3B==2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol/L·min,则此段时间内以C 的浓度变化表示的化学反应速率为( )
A.0.5mol/L·min B.1mol/L·min C.2mol/L·min D.3mol/L·min
![]() 反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在10L容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为( )
反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在10L容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,此反应的平均速率V(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.v (NH3)=0.010mol/L·S B.v (O2)=0.0010mol/L·S
C.v (NO)=0.0010mol/L·S D.v (H2O)=0.045mol/L·S