高二化学上学期期末考试试题(理)
本试卷分第I卷(选择题)和第Ⅱ卷两部分.共9页.
满分100分.考试时间120分钟
第I卷 (选择题,共46分)
可能用到的相对原子质量:H—1 C—12 O—16 Mg—24 A1—27 Fe-56 S-32 Zn-65
一、选择题(本题包括23小题,每小题2分,共46分。每小题只有一个选项符合题意。)
1.我国“神舟六号”载人航天飞船成功发射,表明我国的载人航天技术已居于世界前列。在运载飞船的某些火箭推进器中盛有液态肼(N2H4)和液态双氧水,它们充分混合反应后的产物之一是( )
A.氧气 B.氢气 C.氨气 D.氮气
2.在一定温度下,A2(g)+B2(g) ![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内减少x mol A2,同时生成2x mol AB
B.单位时间内生成x mol B2,同时生成x mol AB
C.单位时间内生成2x mol AB, 同时生成x mol A2
D.容器内压强不随时间变化而变化
3.下列各反应的化学方程式中,属于水解反应方程式的是( )
A. H2O+H2O![]() H3O++OH‐
B. HCO3-+OH‐
H3O++OH‐
B. HCO3-+OH‐![]() H2O+CO32-
H2O+CO32-
C. CO2+H2O![]() H2CO3
D. CO32-+H2O
H2CO3
D. CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
4.下列物质中不属于合金的是( )
A.硬铝 B.黄铜 C.钢铁 D.水银
5.金属的下列性质中和金属晶体无关的是( )
A. 良好的导电性 B 反应中易失电子
C 良好的延展性 D.良好的导热性
6.在Na2S溶液中,下列等式不正确的是( )
A.2c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
B.c(Na+)+c(H+)=2 c(S2-)+c(HS-)+c(OH-)
C.c(H+)+c(HS-)+2c(H2S)= c(OH-)
D.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
7.下列离子方程式书写正确的是( )
A.Al2(SO4)3溶液与氨水混合:Al3++3OH-=Al(OH)3↓
B.Fe粉投入到FeCl3溶液中:Fe+2Fe3+=3Fe2+
C.FeCl3与KI溶液混合:Fe3++ 2I-= Fe2++ I2
D.NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
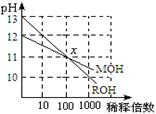
8.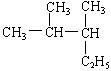 的名称是:( )
的名称是:( )
A 2—甲基—3—乙基丁烷 B 3,4—二甲基戊烷
C 2,3—二甲基—4—乙基丙烷 D 2,3—二甲基戊烷
9.0.1mol/L K2CO3 溶液中,由于CO32- 的水解,使得c(CO32-)< 0.1mol/L ,如果要使c(CO32-)更接近于0.1mol/L,可以采取的措施是( )
A、加入少量盐酸 B、加入适量水 C、加入适量KOH D、加热
10. 下列图中,能表示将 Ba(OH)2 溶液逐滴加入到Al2(SO4)3 溶液中,产生沉淀的质量W g与加入Ba(OH)2 溶液的体积V mL关系的是:( )
![]() W/g W/g
W/g
W/g
W/g W/g
W/g
W/g
 |
A B C D
11.下列各组离子在指定溶液中,能大量共存的是( )
①无色溶液中:K+,Cl—,Na+,SO42—
②使PH=11的溶液中:Na+,AlO2—,S2—,CO32—
③水电离的C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NH4+,SO32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,SO42—
⑤酸性溶液中:Fe2+,Al3+,NO3—,I—
A.①②③④⑤ B.①②⑤ C.①②③④ D.①②④
12.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是( )
A、电离程度:HCN>HClO B、溶液的pH:HCN<HClO
C、与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HCN<HClO
D、酸根离子浓度: C(CN-)<C(ClO-)
13.关于盐类的水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2 S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
14.现有下列4种物质:①![]() ②
②![]() )③
)③![]() ④
④![]() ,其中既能与
,其中既能与![]() 溶液反应,又能与盐酸反应,且都有气体生成的一组是( )
溶液反应,又能与盐酸反应,且都有气体生成的一组是( )
A.①③ B.③④ c.①④ D.②④
15.在一密闭的容器中,反应aA(g) ![]() bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡后,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡后,B的浓度是原来的60%,则( )
A、a>b B、物质A的转化率减少了
C、物质B的体积分数减少了 D、平衡向正方向移动了
16.某混合气体由两种气态烃组成, 取2.24L该混合气体完全燃烧后得到4.48L CO2(气体均已折算为标准状况)和3.6g水,则这两种气体可能是( )
A.CH4 C3H8 B. CH4 C3H6 C. C2H2 C3H4 D. C2H2 C2H6
17.将铁、铜用导线连接插入硫酸铜溶液中,当导线中有0.2mol电子通过时,负极的质量变化为 ( )
A.增加5.6g B.增加11.2g C.减少5.6g D.减少11.2g
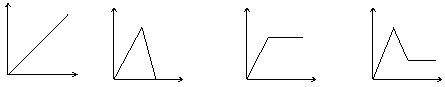
 18.MOH和ROH两种一元碱的溶液分别加水稀释时,
18.MOH和ROH两种一元碱的溶液分别加水稀释时,
pH变化如右图所示。下列叙述中不正确的是( )
A.MOH是一种弱碱 B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH) =10 c(MOH)
19.某原电池总反应的离子方程式为 2Fe3+ +Fe = 3Fe2+ ,可以实现上述反应的原电池是( )
| 正 极 | 负 极 | 电解质溶液 | |
| A | C | Cu | Fe2(SO4)3 |
| B | Ag | Fe | FeCl3 |
| C | Cu | Fe | CuSO4 |
| D | Fe | Zn | Fe2(SO4)3 |
20.描述CH3-CH=CH-C≡C-CF3分子结构的下列叙述中正确的是( )
①、6个碳原子有可能都在一条直线上
②、6个碳原子不可能都在一条直线上
③、6个碳原子有可能都在同一平面上
④、6个碳原子不可能都在同一平面上
A.①③ B.①④ C.②③ D.②④
21.将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A、0.1mol/L B、0.05mol/L C、0.2mol/L D、无法计算
22.某烃的一种同分异构体只能生成一种一氯化物,该烃的分子式可能是( )
A.C3H8 B.C4H10 C.C5H12 D.C6H14
23.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物。请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A、ZnC2水解生成乙烷(C2H6) B、Al4C3水解生成丙炔(C3H4)
C、Mg2C3水解生成丙炔(C3H4) D、Li2C2水解生成乙烯(C2H4)
第Ⅱ卷(满分54分)
二.填空(共22分)
24.(12分)完成下列化学方程式或离子方程式.
(1)__ Mg + __CO2 ![]() _______+_____
_______+_____
(2) __Al + __MnO2 ![]() _____+_____
_____+_____
(3) Al(OH)3 + 3H+ ===___________
(4) Al3+ +3 OH- ===_________
(5) Al3+ + 4OH- ===______________
(6) __Al3+ +__AlO2-+ __H2O ===_______
25.(4分)在下列物质中:①O2 ②O3 ③![]() ④
④![]()
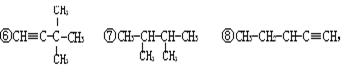
其中属于同系物的是 ;属于同分异构体的是 ;属于同素异形体的是 ;属于同位素的是 。
26.(6分)1摩尔某有机物能与1摩尔H2发生加成反应,其加成后的产物是 2,2,3-三甲基戊烷,则此有机物可能的结构简式有 、 、 。
三.实验题(共12分)
27.(12分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1) 写出甲同学实验中两个主要反应的化学方程式:
(2)甲同学设计的实验 (填“能” 或“不能”)验证乙炔与溴发生加成反应,其理由是 。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并在方框下的括弧内写出装置内所放的化学药品。
(a) (b) (c) (d)
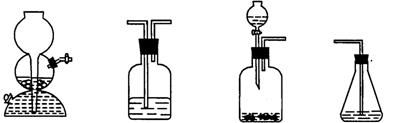
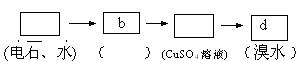
(已知:H2S+CuSO4=CuS↓ +H2SO4 )
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是
。
四.推断题(共14分)
28.(8分).有一无色透明的溶液做如下实验:
(1)取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
(2)另取部分溶液加入Na2O2(微热),有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
试问: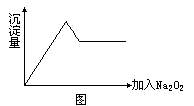
![]() 等离子中一定存在的离子是
;可能存在的离子是
;一定不存在的离子是
。(2)上述溶液至少由
等物质混合成。
等离子中一定存在的离子是
;可能存在的离子是
;一定不存在的离子是
。(2)上述溶液至少由
等物质混合成。
29.(共6分)甲、乙是2种常见的短周期元素的单质,它们的性质如图13-4。其中C为白色沉淀,D为气体。
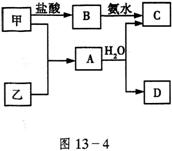
(1)若D为酸性气体,则c的化学式为___________。乙是___
(2)若D为碱性气体,则![]() 的化学方程式为__________________。
的化学方程式为__________________。
(3)若由2种元素组成的化合物M发生水解,只生成2种酸X和Y,则下列说法中正确的是_________(填序号)。
①M可能由两种非金属组成 ②X、Y一定为一元酸 ③M一定含有金属元素
④此反应可能为氧化还原反应 ⑤生成物中无氧酸、含氧酸并存
五.计算题(共6分)
30.(6分)由铜片、锌片和1000mL0.2mol/L稀H2SO4组成的原电池中,若锌片只发生电化腐蚀,则当在铜片上共放出3.36L(标准状况)气体时,产生这些气体消耗锌多少克?有多少个电子通过了导线?反应后溶液的PH为多少?(设:忽略溶液的体积变化)
上学期期末考试
高二化学试题(理)答案卷
第Ⅱ卷(满分54分)
二.填空(共22分)
24、(每小题2分,共12分)
(1)_______________________________________
(2)________________________________________
(3) ____________________________________________
(4)____________________________________________
(5)_______________________________________________
(6)________________________________________________
25、(每空1分,共4分)
_________________;______________;___________________;____________________
26、(每空2分,共6分)
__________________________;___________________________;__________________
三.实验题(共12分)
27(共12分)
(1)______________________________________________________
________________________________________________________
(2)________;__________
(3)__________;_____________________________________
(4)__________;____________________;______________________
(5)________________________________________________________________
___________________________________________________
四.推断题(共14分)
28、(每空2分,共8分)
__________________;______________;_____________;__________________
29、(共6分)
(1)_______________;_________________
(2)_________________________________________________(3)__________
五.计算题(共6分)
30、(共6分)
解: