高二化学![]()
 上学期期中考试试题(理)
上学期期中考试试题(理)
命题人 雷文慧
I卷(选择题)
原子量Na 23 Mg 24 Al 27 Fe 56 O 16 N 14 S 32 Cl 35.5
一、选择题(每小题只有一个选项符合题意)
1、对于反应4A+5B![]() 4C+6D来说,以下化学反应速率的表示中,反应速率最快的是( )
4C+6D来说,以下化学反应速率的表示中,反应速率最快的是( )
A、V(A)=0.40mol/(L·S)
B、 B、V(B)=0.48mol/(L·S)
C、V(C)=0.36mol/(L·S)
D、D、V(D)=0.55mol/(L·S)
2、可逆反应:2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是()
2NO+O2在密闭容器中反应,达到平衡状态的标志是()
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2: 2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A ①④⑥B ②③⑤C ①③④D ①②③④⑤⑥
3、一定温度下,某容积不变的密闭容器中,反应达平衡状态,此时测得各物质的浓度分别是c(SO2)=2.0 mol/L c(O2)=0.8 mol/L c(SO3)=2.4 mol/L,则SO2起始浓度的取范围是( )
A、0—4.0mol/L B、0.4—4.0 mol/L
C、0.4—4.4 mol/L D、0—4.4mol/L
4、在反应容器中充入1mol A气体和n mol B气体,在一定条件下发生反应
A(g)+ n B(g)![]() mC(g):,达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的3/4,则n和m的数值可能是( )
mC(g):,达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的3/4,则n和m的数值可能是( )
A.n=1 m=1 B n=2 m=2
C n=3 m=3 D n=2 m=3
5、漂白粉在溶液中存在下列平衡体系:ClO—+H2O![]() HClO+OH—(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
HClO+OH—(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
A降低温度 B加入大量的水
C加入适量盐酸 D加入适量烧碱溶液
6、反应2A(g)+B(g)![]() 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示。
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如下图所示。
下述判断正确的是( )
A T1>T2,p1>p2
B T1<T2,p1>p2 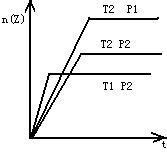
C T1>T2,p1<p2 D T1>T2,p1<p2
7、对已达平衡的下列反应:2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
8、下列事实,不能用勒夏特列原理解释的是
A 合成氨反映在加热条件(500°C左右)下比在室温条件下进行更有利
B 氯水宜保存在低温、避光条件下
C 实验室常用浓氨水与NaOH固体混合物来制取氨气
D SO2催化氧化成SO3的反应,往往加入过量的空气
9、体积相同的甲、乙两个容器中,
都分别充有等物质的量的SO2和O2,在相同温度下发生反应2SO2+O2![]() 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
A等于P% B 大于P%
C 小于P% D无法判断
10、将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起 ( )
A 溶液的pH增大 B CH3COOH电离度变大
C 溶液的导电能力减弱 D溶液中c(OH—)减小
11、分别取pH均等于2的盐酸和醋酸各100mL,稀释2倍后,在分别加入0.325g锌粉,在相同条件下充分反应,下列有关叙述正确的是( )
A 反应开始时,盐酸和醋酸分别与锌反应的速率一样大
B 盐酸和醋酸分别与锌反应放出的氢气一样多
C 反应开始时,盐酸与锌反应速率大
D 醋酸与锌反应放出氢气多
12、把1ml0.1mol L—1的H2SO4加水稀释,制成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于( )
A 、1![]() 10—4 mol· L—1
B、1
10—4 mol· L—1
B、1![]() 10—8 mol·L—1
10—8 mol·L—1
C、 1![]() 10—11 mol ·L—1
D、1
10—11 mol ·L—1
D、1![]() 10—10 mol ·L—1
10—10 mol ·L—1
13、在由水电离出的c(H+)=1![]() 10—13 mol· L—1的溶液中,一定能大量共存的离子组是( )
10—13 mol· L—1的溶液中,一定能大量共存的离子组是( )
A Ba2+、Na+、NO3—、Cl—
B Fe2+、NO3—、Na+、Cl—
C NH4+、Na+、AL3+、SO42—
D Mg2+、NO3—、ALO2—、Br—
14、等物质的量浓度的下列溶液中,NH4+离子浓度最大的是( )
A NH4Cl B CH3COONH4
C NH4HCO3 D NH4HSO4
15、某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各离子的浓度关系不正确的是( )
A c(Na+)> c(HA—)>c(H+)>c(A2—)>c(OH—)
B c(Na+)+C(H+)=c(HA—)+2c(A2—)+c(OH—)
C c(H+)+c(A2—)=c(OH—)+c(H2A)
D c(Na+)=c(HA—)+c(H2A)+c(A2—)
16用某种仪器测量一液体的体积时,平视读数为n mL,仰视读数为x mL,俯视读数为y mL。若x> n> y,则使用的仪器可能是()
A烧杯 B 量筒
C 酸式滴定管 D 容量瓶
17、在硫酸铝、硫酸钾、明矾三种物质的混合溶液中,c(SO42—)=0.2mol/L,向其中加入等体积的0.2mol/LKOH溶液,使生成的白色沉淀又恰好溶解,则原混合溶液中c(K+)为 ( )
A 0.15mol/L B 0.25mol/L
C 0.225mol/L D 0.45mol/L
18、在同体积pH=3的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量锌粉,下列说法正确的是:( )
A H2SO4中放出H2最多
B 醋酸中放出H2最多
C HCl和HNO3放出H2一样多
D HCl比HNO3 放出H2多
19、用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是 ( )
A 未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗
B 装待测液的锥形瓶,洗涤后未干就盛入待测液
C 滴完开始时,用俯视法观察碱式滴定管刻度,其余操作正确
D滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液
20、常温下,强酸溶液A和强碱溶液B的pH之和为16,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是 :( )
A 1:10 B 10:1 C 1:100 D 100:1
II卷
二、填空题
21、(12分)下面a-e是中学化学实验中常见的几种定量仪器:a、量筒;b、容量瓶;c、滴定管;d、托盘天平;e、温度计
(1)其中标示出仪器使用温度的是 (填写编号);
(2)能够用以精确量取液体体积的是 (填写编号);
(3)由于错误操作,使得到的数据比正确数据偏小的是 (填写编号);
A、用量筒量取一定量的液体时,俯视液面读数
B、中和滴定达终点时俯视滴定管内液面度数
C、使用容量瓶配置溶液时,俯视液面定容后所得溶液的浓度
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 克。
22、(10分)某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
A、移取20ml待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B、用标准溶液润洗滴定管2-3次
C、把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D、取KOH标准溶液注入碱式滴定管至刻度0以上2—3厘米
E、调节液面至0或0以下刻度,记下读数
F、把锥形瓶放在滴定管的下面,用标准的KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成。
填空:⑴正确操作步骤顺序是(用序号字母填写)
⑵上述B步骤操作的目的是
⑶上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
⑷判断到达滴定终点的实验现象是:
⑸若称量一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果的影响是 23、(12分)硫酸氢钾溶液显 性( 填“酸”、“碱”或“中”下同),用方程式表示为 ;
碳酸氢钠溶液显 性,用方程式表示为 ;
硫酸铵溶液显 性,用方程式表示为 ;将上述三种溶液混合,现象是 ;
反应的离子方程式为
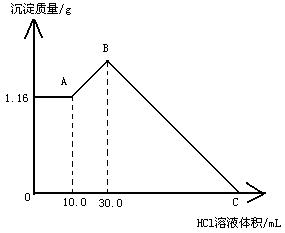
24、(12分)把NaOH、MgCl2、AlCl3、三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00 mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:
⑴A点的沉淀物的化学式为
⑵写出A点至B点发生反应的离子方程式
⑶原混合物中MgCl2的质量是 g、
AlCl3的质量为 g、
NaOH的质量为 g
⑷C点HCl溶液的体积为 mL。
三、计算题
25、(14分)在一个容积为500mL的密闭容器中,充入5mol H2和2mol CO,在一定温度,一定压强下,发生如下反应:H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
经5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2mol/L,求:
⑴以H2的浓度变化表示的该反应的速率?
⑵达平衡时CO的转化率?
⑶平衡混合气体的密度与相同状况下的氢气的密度之比?