高二化学模拟试卷(三)
可能用到的相对原子原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Cl:35.5
第Ⅰ卷(选择题 共56分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共24分。)
|
A.正四面体形
B.正六面体
C.正八面体形
D.三角锥形
2.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确 ( )
A .13C与15N有相同的中子数 B .13C与C60互为同素异形体
C .15N与14N互为同位素 D .15N的核外电子数与中子数相同
3.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.可溶于水B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
4.下列叙述正确的是 ( )
A .P4和NO2都是共价化合物 B .CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中,都不存在单个小分子
D.甲烷的分子是对称的平面结构,所以是非极性分子
5.下列叙述正确的是 ( )
A.同周期元素的原子半径为ⅦA族的为最大B.在周期表中零族元素的单质从上到下熔沸点逐渐降低 C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
6.某密闭密闭容器中进行如下反应:X(g)+2Y(g)![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
A.1<X/Y<3; B.1/4<X/Y<2/3 C.3< X/Y <4; D.1/4< X/Y <3/2
7.PH=12的NaOH溶液和PH=10的NaOH溶液混和后溶液的 ( )
A.PH=11 B.PH=10.3 C.C(H+)=2×10-12mol/L D.C(H+)=5×10-11mol/L
8.具有如下电子层结构的原子,其相应元素一定属于同一主族的是 ( )
 A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子
A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子
B.3p亚层上只有1个空轨道的原子和4p亚层上只有1个空轨道的原子
C.最外层电子排布为1s2的原子和最外层电子排 布为2s22p6的原子
D.最外层电子排布为1s2的原子和最外层电子排 布为2s2的原子
二、选择题(每小题有一个或两个选项符合题意,每小题4分,只选择一个且正确得2分,多选或错选得0分,共32分。)
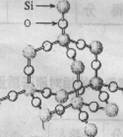
9.二氧化硅晶体是空间网状结构,如右图所示。关于二氧化硅晶体的下列说法中,不正确的是 ()
A.1 mol SiO2 晶体中Si—O键为2mol B.晶体中Si、O原子个数比为1:2
C.晶体中Si、O原子最外电子层都满足8电子结构 D.晶体中最小环上的原子数为8
10.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是 ( )
A.c(A-)≥c(M+) B.c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(H+) D.若MA水解,则c(OH-)>c(H+)
11.据报道,科学家最近确认世界上还存在着另一种结构与C60相似的“分子足球N60”。N60在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法正确的是( )
A.N60是共价键构成的一种原子晶体 B.熔点:N60比N2高
C.稳定性:N60比N2高 D.等物质的量分解吸收的热量N60比N2高
12.下列关于杂化轨道的叙述中,不正确的是 ( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子
C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C都是通过sp3杂化轨道成键
D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
13.在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2
是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之
溶解。欲除去溶液中的杂质离子,下述方法正确的是 ( )
A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀 C.直接加水加热使杂质离子水解除去 D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
14.在一密闭容器中有如下反应:aX(g)+bY(g) ![]() nW(g);ΔH=Q
nW(g);ΔH=Q
某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
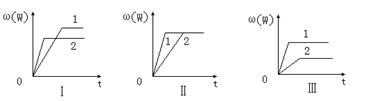
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是 ( )
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
15.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是 ( )
A.b=a-n-m B.离子半径Am+<Bn- C.原子半径A<B D.A的原子序数比B大(m+n)
16.一定温度下,取0.2 mol/L HX溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化,下同)得溶液甲;另取0.2 mol/L HX溶液与0.1 mol/L NaOH溶液等体积混合得溶液乙。测得溶液甲的pH=8,溶液乙的pH>7。下列结论错误的是 ( )
A.甲溶液中由水电离出的c(OH¯) > 0.2 mol/L HX溶液中由水电离出的c(H+)
B.甲溶液中c(Na+) — c(X-)=1.0×10−8 mol/LC.甲溶液中c(OH-) — c(HX) =1.0×10−8 mol/L
D.相同条件下,HX的电离程度 > NaX的水解程度
泰兴市第二高级中学期末考试
高二化学模拟试卷(三)
第Ⅱ卷(非选择题 共64分)
三、(本题包含4小题共46分)
17.(10分)甲、乙、丙、戊都具有如下图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。
 已知:甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团,常温下丁呈液态,能产生两种等电子数的粒子,戊是阳离子。
已知:甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团,常温下丁呈液态,能产生两种等电子数的粒子,戊是阳离子。
(1) 写出液态丁产生两种等电子粒子的电离方程式: 。
(2) 室温下含有戊的盐溶液,其pH D 。
A.>7 B.=7 C.<7 D.以上都有可能
(3) 丙是目前重要的能源。
① 丙和丁在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是
。
② 丙可用作现代高能燃料电池中的原料,则丙所在的电极名称是(填“正极”或“负极”) 。
(4) 甲、乙高温反应时,若乙平均被破坏了1 mol共价键,则参加反应的乙为 15 g。
18.(6分)W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为
1:1,Y原子最外层s电子与p电子数之比为1:1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为 < (用分子式表示)。
(3)这四种元素原子半径的大小为 > > > (填元素符号)
19.(6分)碳正离子[例如CH![]() 、CH
、CH![]() 、(CH3)3C+等]是有机反应中重要的中间体.欧拉(G·Olan)因在此领域中的卓越成就而荣获1994年诺贝尔化学奖.碳正离子CH
、(CH3)3C+等]是有机反应中重要的中间体.欧拉(G·Olan)因在此领域中的卓越成就而荣获1994年诺贝尔化学奖.碳正离子CH![]() 可以通过CH4在“超强酸”中获得一个H+而得到.而CH
可以通过CH4在“超强酸”中获得一个H+而得到.而CH![]() 失去H2可得CH+3.
失去H2可得CH+3.
(1)CH![]() 是反应性很强的正离子.是缺电子的.其电子式是__________.
是反应性很强的正离子.是缺电子的.其电子式是__________.
(2)CH![]() 中四个原子是共平面的.三个键角相等.键角应是__________.
中四个原子是共平面的.三个键角相等.键角应是__________.
(3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子.其结构简式是_________________.
20.(12分)氮化钠(Na3N)是科学家制备的一种重要的化合物.它与水作用可产生NH3.请回答下列问题:(1)Na3N的电子式是__________.该化合物是由__________键形成.
(2)Na3N与盐酸反应生成__________种盐.其电子式分别是__________.
(3)Na3N与水的反应属于__________(填基本反应类型)反应.
(4)比较Na3N中两种粒子的半径:r(Na+)__________r(N3-)(填“>”“=”“<”).
21.(6分)(1)若纯水中水的电离度为![]() 1,pH=x的盐酸中水的电离度为
1,pH=x的盐酸中水的电离度为![]() 2,pH=y的氨水中水的电离度为
2,pH=y的氨水中水的电离度为![]() 3,两溶液等体积混合后溶液中水的电离度为
3,两溶液等体积混合后溶液中水的电离度为![]() 4,若x+y=14(其中x≤6,y≥8),则
4,若x+y=14(其中x≤6,y≥8),则![]() 1、
1、![]() 2、
2、![]() 3、
3、![]() 4从小到大的顺序是:____________________。
4从小到大的顺序是:____________________。
(2)在25℃时,0.1mol/L NaR的溶液中水的电离度为![]() 1,在0.1mol/L盐酸中水的电离度为
1,在0.1mol/L盐酸中水的电离度为![]() 2,若
2,若![]() 1∶
1∶![]() 2=109,则0.1mol/L
NaR溶液的pH为_______。
2=109,则0.1mol/L
NaR溶液的pH为_______。
(3)已知浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH
⑥CH3COONa ⑦KCl ⑧NH4Cl其溶液pH由小到大的顺序是______________________
22.(6分)A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子排布式为nsnnp2n.C、D两原子的最外层电子数分别是内层电子数的一半.C元素是植物生长的营养元素之一.试写出:
(1)A、B元素形成的酸酐的化学式 ;
(2)D元素的单质与水反应的化学方程式 ;
(3)A、C元素气态氢化物的稳定性大小 < (用分子式表示).
四.(本题包含2小题共18分)
23.(9分)2003年10月17日晨6时许,载着航天英雄杨利伟的“神舟”五号飞船在内蒙古大草原成功着陆,我国首次载人航天飞行取得圆满成功。发射“神舟”飞船的长征2号火箭用了肼(N2H4)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼与盐酸反应的离子方程式 。
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比1:2反应生成肼,试写出该反应的化学方程式 。该反应中 是氧化产物。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出热化学方程式 。
(4)为使宇航员有良好的生存环境,宇宙飞船中装有盛Na2O2颗粒的供氧装置,如用KO2(超氧化钾)代替Na2O2,能达到同样的目的。写出KO2与CO2反应的方程式 。
24.(9分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol、D为6.5 mol、F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
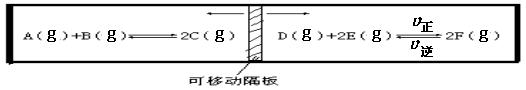
(1) 若x = 4.5,则右侧反应在起始时向___________(填“正反应”或“逆反应”)方向时进行,则x的最大取值应小于____________。(注意:要写出计算过程 否则不给分)
.(1) 正反应 7.0 提示:设达平衡时E的消耗量为2a mol。
D + 2E ![]() 2F
2F
起始时: 6.5 x 2.0
平衡时: 6.5-a x-2a 2.0+2a
因左侧反应混合物总的物质的量为12 mol,所以达平衡时,右侧反应需满足:
(6.5-a)+(x-2a)+(2.0+2a) = 12 x =3.5+a
x -2a>0 x>2a
解之:x<7.0
(2) 若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?_不相等; (填“相等”、“不相等”或“不能确定”)。其理由是:
(2) 因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同。(注:① 凡是答成“相等”的,无论理由是否正确,此小题均为0分。② 对于理由,需答出“不同温度下”或“温度不同”等含义,否则此空为0分。)
高二化学模拟试卷(三)答卷纸 姓名______学号_______
三、17.(10分)(1) 。 (2)
(3) ① 。 ② 。
(4) g。
18.(6分)(1) (2) < (用分子式表示)。
(3) > > >
19.(6分)(1) (2) (3)
20.(12分)(1) 、 (2) 、 (3) (4)
21.(6分)(1) (2) (3)
22.(6分)(1) ;(2) ;
(3) < (用分子式表示).
四、23.(9分)(1)
(2) 、
(3) ________
(4)
24.(9分)
(1) ___________ ____________。(注意:要写出计算过程 否则不给分)
(2) __________(填“相等”、“不相等”或“不能确定”)。其理由是:________________
___________________________________________________________。