高二化学平衡的复习
一、化学平衡
【内容综述】
①概念、特征:一定条件下可逆反应,当正反应速率和逆反应速率达到相等时,反应混合物各组分百分含量不随时间变化而改变,此时可逆反应就达到了平衡状态。
②影响因素:浓度、压强、温度――勒沙特列原理
【要点讲解】化学反应是否达到平衡状态,关键是看反应混合物各组分百分含量是否还随时间发生变化。
【例题分析】
![]() 例1:下列叙述中能表示可逆反应N2+3H2 2NH3一定处于平衡状态的是:
例1:下列叙述中能表示可逆反应N2+3H2 2NH3一定处于平衡状态的是:
A、N2、3H2、NH3百分含量相等
B、单位时间内,消耗1molN2的同时消耗3molH2
C、单位时间内,消耗1molN2的同时生成3molH2
D、反应若在定容的密闭容器中进行,温度一定时,压强不随时间改变
![]() 例2:在一个不传热的固定容积的密闭容器中可逆反应
例2:在一个不传热的固定容积的密闭容器中可逆反应
mA(g)+nB(g) pC(g)+(g)当m、n、p、q为任意整数时,达到平衡的标志是:
①体系的压强不再改变 ②体系的温度不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率Va:Vb:Vc:Vd=m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
(A)③④⑤⑥ (B) ②③④⑥ (C)①③④⑤ (D) ①③④⑥
【能力训练】
![]() 3、在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
3、在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
A、单位时间内生成nmolA2,同时生成nmol 的AB
B、容器内总压强不随时间而变化
C、单位时间内生成2n molAB,同时生成n mol的B2
D、单位时间内生成n molA2,同时生成n mol的B2
![]() 4、能够说明可逆反应H2(g)+I2(g) 2HI(g)已达平衡状态的是
4、能够说明可逆反应H2(g)+I2(g) 2HI(g)已达平衡状态的是
A、一个H-H键断裂的同时有一个H-I键形成
B、一个I-I键断裂的同时有二个H-I键形成
C、一个H-H键断裂的同时有一个H-H键形成
![]() D、一个H-H键断裂的同时有二个H-I键形成
D、一个H-H键断裂的同时有二个H-I键形成
5、在2NO2 N2O4的可逆反应中,下列状态说明达到平衡的标志是(当条件一定时)
A、c(N2O4)=c(NO2)的状态 B、容器内的总压强不再变化
C、NO2和N2O4的分子数之比为2:1的状态 D、NO2的转化率不再变化
![]() 6、在一个6L的密闭容器中,盛入3L X和2L Y,在一定条件下,发生反应:
6、在一个6L的密闭容器中,盛入3L X和2L Y,在一定条件下,发生反应:
4X(g)+3Y(g) 2Q(g)+3R(g)若开始时加热,当反应进行到一定阶段后,采取绝热措施,容器里的温度不再随时间改变,这说明
A、正反应为放热反应
B、正反应为吸热反应
C、该反应中正反应吸热和逆反应放热相等,表现为既不吸热也不放热
D、该可逆反应达到了平衡状态
二、化学平衡移动
【内容综述】
掌握平衡移动原理
运用影响平衡移动的因素判断平衡移动方向
【要点讲解】
化学平衡移动的实质是浓度、温度、压强等客观因素对正、逆反应速率变化产生不同的影响,使V正≠V逆,原平衡状态发生移动,根据平衡移动原理分析解决问题。
【例题分析】
![]() 一、平衡移动与反应速率
一、平衡移动与反应速率
例1、某温度下,反应N2O4 2NO2-Q在密闭容器中达到平衡,下列说法不正确的是
A、体积减小时将使反应速率增大
B、体积不变时加入少许NO2,将使正反应速率减小
C、体积不变时加入少许N2O4,再度平衡时颜色变深
D、体积不变时升高温度,再度平衡时颜色变深
![]() 二、化学平衡移动的运用
二、化学平衡移动的运用
例2、在A+B(s) C反应中,若增加压强或降低温度,B的转化率均增大,
则反应体系应是
A、A是固体,C是气体,正反应吸热 B、A是气体,C是液体,正反应放热
C、A是气体,C是气体,正反应放热 D、A是气体,C是气体,正反应吸热
![]() 例3、在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均分子量减小的是
例3、在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均分子量减小的是
A、H2(g)+Br2(g) 2HBr(g)+Q
![]()
![]() B、N2(g)+3H2(g) 2NH3(g)+Q
B、N2(g)+3H2(g) 2NH3(g)+Q
![]() C、N2O4(g) 2NO2(g)-Q
C、N2O4(g) 2NO2(g)-Q
D、4NH3(g)+5O2(g) 4NO(g)+6H2O(g)+Q
![]() 三、其它因素与平衡
三、其它因素与平衡
例4、在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q反应达到平衡后,欲使颜色加深,应采取的措施是
A、升温 B、降温 C、增压 D、减压
【能力训练】
![]() 5、在一个固定体积的密闭容器中,放入3 L X(g)和2 L Y(g),在一定条件下发生下列反应4X(g)+3Y(g) 2Q(g)+nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应方程式中的n值是
5、在一个固定体积的密闭容器中,放入3 L X(g)和2 L Y(g),在一定条件下发生下列反应4X(g)+3Y(g) 2Q(g)+nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减少1/3,则该反应方程式中的n值是
![]() A、3 B、4 C、5 D、6
A、3 B、4 C、5 D、6
6、一定混合气体在密闭容器中发生下列反应:mA(气)+nB(气) pC(气),达到平衡后,于温度一定时,将气体体积缩小到原来的1/2,当达到新的平衡时,C的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法中正确的是
A、m+n>p B、A的转化率降低
![]() C、平衡向逆反应方向移动 D、C的体积分数增加
C、平衡向逆反应方向移动 D、C的体积分数增加
7、对于可逆反应A2(g)+3B2(g) 2AB3(g)+Q,下列图象不正确的是
![]() V AB3%
V AB3%
V正 V逆 100℃
200℃
A T B t
 AB3% AB3%
AB3% AB3%
1×106Pa 100℃
1×107Pa 200℃
C T D P
![]()
 9、在一定条件下将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X、Y的转化率与起始时两物质的物质的量之比(MX/MY)的关系如下图所示:则X和Y的反应方程式可表示为
转化率
9、在一定条件下将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X、Y的转化率与起始时两物质的物质的量之比(MX/MY)的关系如下图所示:则X和Y的反应方程式可表示为
转化率
![]() A、3X+Y Z Y
A、3X+Y Z Y
![]() B、2X+Y Z
B、2X+Y Z
![]() C、X+3Y Z
C、X+3Y Z
D、3X+Y 2Z X
![]() 0 1 2 3 起始时MX/MY
0 1 2 3 起始时MX/MY
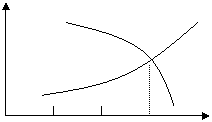
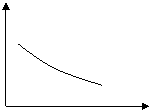 10、可逆反应2A+B 2C(g)+Q,随温度变化气体平均相对分子质量如下图所示,则下列叙述正确的是
10、可逆反应2A+B 2C(g)+Q,随温度变化气体平均相对分子质量如下图所示,则下列叙述正确的是
A、A和B可能都是固体 气体平均相对分子质量
B、A和B一定都是气体
C、若B为固体则A一定为气体
D、A和B可能都是气体
温度℃
![]()
 11、在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的百分含量,该反应是 R% T1P2
11、在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的百分含量,该反应是 R% T1P2
A、正反应是吸热反应,L是气体 T2P2
B、正反应是放热反应,L是气体 T2P1
C、正反应是吸热反应,L是固体
D、正反应是放热反应,L是固体或液体 0
时间
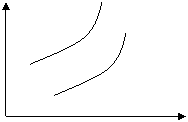
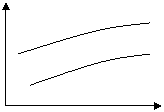
![]() 8、在可逆反应aX+bY cZ+dW中,X、Y、Z、W均为气体,下图是表示平衡时W的百分含量随温度(T),压强(P)的变化曲线。试回答:
8、在可逆反应aX+bY cZ+dW中,X、Y、Z、W均为气体,下图是表示平衡时W的百分含量随温度(T),压强(P)的变化曲线。试回答:
①正反应是放热反应的有 ,②a+b<c+d的有 ,③a+b=c+d的有 。
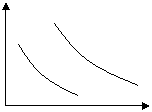
 W% W%
W% W%
1P 1P
10P 10P
0 T 0 T
A B

 W%
W%
W%
W%
1P或10P 10P
1P
0 T 0 T
C D
![]()
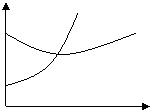
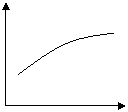
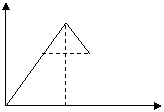 9、对于反应2A+B 2C在反应过程中C的百 C%
9、对于反应2A+B 2C在反应过程中C的百 C%
分含量随温度变化如右图,则:①T0对应的V正与
V逆的关系是 。②正反应为 热反应。 A B
③A、B两点正反应速率的大小关系是 。
④温度T<T0时,C%逐渐增大的原因是 。
0 T0 T
![]()
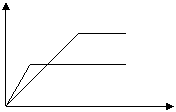
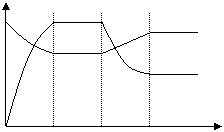 6、今有X(g)+Y(g) 2Z(g)+Q, 从反应开始经过t1s后达到平衡状态,t2s时由于条件改变,平衡受到破坏,在t3s时又达到平衡。根据下图回答:从t2s到t3s间的曲线变化是由哪种条件引起的
c Z
6、今有X(g)+Y(g) 2Z(g)+Q, 从反应开始经过t1s后达到平衡状态,t2s时由于条件改变,平衡受到破坏,在t3s时又达到平衡。根据下图回答:从t2s到t3s间的曲线变化是由哪种条件引起的
c Z
A、增大X或Y的浓度 X或Y
B、增大压强 X或Y
C、增大Z的浓度 Z
D、升高温度
0 t1 t2 t3 时间