高二化学期末复习《化学平衡》练习题
一、选择题(1-2个答案。注意:请将选择题的答案写在题号左侧)
1.在A+pB![]() qC(p、q为化学计量数)反应中,经t秒后C的物质的量浓度增大m mol/l。若用B的物质的量浓度来表示,其反应速率是
qC(p、q为化学计量数)反应中,经t秒后C的物质的量浓度增大m mol/l。若用B的物质的量浓度来表示,其反应速率是
A.![]() mol/L·s B.
mol/L·s B.![]() mol/L·s
C.
mol/L·s
C.![]() mol/L·s
D.
mol/L·s
D.![]() mol/L·s
mol/L·s
2.能增加气体反应中反应物分子中活化分子的百分数的是
A. 升高温度 B. 使用催化剂 C. 增大压强 D. 增加浓度
|
A.2—Saob B.1—Saob
C.2—Sabdo D.1—Sbod
4.某温度下有反应:S2Cl2(液态,无色)+Cl2(气)![]() 2SCl2(液态,红色)+热量 在密闭容器中达到平衡,下列说法不正确的是
2SCl2(液态,红色)+热量 在密闭容器中达到平衡,下列说法不正确的是
A.升高温度而压强不变,液体颜色变浅 B.温度不变而缩小容器体积,液体颜色加深
C.温度不变,而增大容器体积,S2Cl2的转化率降低
D.温度降低,而体积不变,Cl2的转化率降低
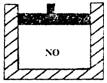 5.如图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度
5.如图为装有活塞的密闭容器,内盛22.4mL一氧化氮。若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内的密度
A.等于1.369 g/L B.等于2.054 g /L
C.在1.369g/L和2.054g/L之间 D.大于2.054g/L
6、在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:![]() A(g)+2B(g)C(g)+D(g)已达平衡的是
A(g)+2B(g)C(g)+D(g)已达平衡的是
A、混合气体的压强 B、混合气体的密度
C、B的物质的量浓度 D、气体的总的物质的量
7.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)===zC(g),达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大一倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
A 平衡向右移动 B x+y >z C B的转化率提高 D C的体积分数增加
8. 在1只固定容积的密闭容器中,放入3L气体X和2L气体Y,在一定条件下发生了下列反应:4X(g)+3Y(g) ![]() 2Q(g)+nR(g)达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小1/3.则此反应中的n值是
2Q(g)+nR(g)达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小1/3.则此反应中的n值是
A.3 B.4 C.5 D.6
9.下列说法中,可以证明反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
A.1个N≡N键断裂的同时,有3个H—H键形成 B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂 D.1个N≡N键断裂的同时,有6个N—H键形成
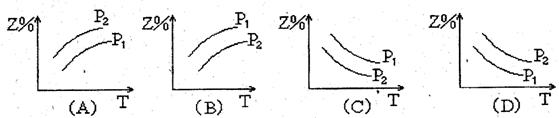
10.反应:X(气)+3Y(气) ![]() 2Z(气)(正反应放热),在不同温度、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为
2Z(气)(正反应放热),在不同温度、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为
11下列措施或事实不能用勒沙特列原理解释的是
A 新制的氯水在光照下颜色变浅 B H2、I2(g)、HI平衡混合气加压后颜色变深
C 硫酸工业上SO2氧化成SO3,宜采用空气过量 D 合成氨反应常采用20MPa~50MPa
![]() 12.某温度下,在固定容积的密闭容器中,可逆反应A(g)+ 3B(g) 2C(g)达到平衡时,各物质的物质的量之比为 n(A):n(B):n(C)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入A、B、C则
12.某温度下,在固定容积的密闭容器中,可逆反应A(g)+ 3B(g) 2C(g)达到平衡时,各物质的物质的量之比为 n(A):n(B):n(C)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入A、B、C则
A.平衡不移动 B.再达平衡时,n(A):n(B):n(C)仍为2:2:1
C.再达平衡时,C的体积分数增大 D.再达平衡时,正反应速率增大,逆反应速率减小
13.在一固定容积的密闭容器中充入1molNO2,一定温度下建立如下平衡:2NO2![]() N2O4 ,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是
N2O4 ,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是
A .x>y B .x<y C. x=y D.不能确定
|
14、已知工业上真空炼铷的方程式为2RbCl + Mg ====== MgCl2 +2Rb(g),对于此反应能
够进行正确解释的是
A.Rb比Mg金属性强 B.MgCl2对热的稳定性比RbCl弱
C.高温下Mg2+得电子能力比Rb+弱 D.Rb的沸点比Mg低,当把Rb(g)抽走时,平衡向正反应向移动
15.将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2 C.2 mol SO2+1mol O2 +2 mol SO3D.3 mol SO2+1 mol SO3
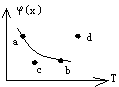
![]() 16、可逆反应nx(g)+y(g)
mz(g)-Q当反应达到平衡后,混合气体中x的体积分数
16、可逆反应nx(g)+y(g)
mz(g)-Q当反应达到平衡后,混合气体中x的体积分数![]() (x)与温度(T)的关系如图所示,a点和b点是反应达到平衡时曲线上的两点,c点和d点是反应未达到平衡时曲线外的两点。若密闭容器中以定压条件进行反应,当V正>V逆时,则在右图中可表明此种情况的点是
(x)与温度(T)的关系如图所示,a点和b点是反应达到平衡时曲线上的两点,c点和d点是反应未达到平衡时曲线外的两点。若密闭容器中以定压条件进行反应,当V正>V逆时,则在右图中可表明此种情况的点是
A、a点
B、b点
C、c点
D、d点
17.在一密闭容器中进行如下反应:2SO2 +
O2 ![]() 2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/l、0.1 mol/l、0.2 mol/l。当反应达平衡时,可能存在的数据是
2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/l、0.1 mol/l、0.2 mol/l。当反应达平衡时,可能存在的数据是
A.SO2为0.4 mol/l,O2为0.2 mol/l B.SO2为0.25 mol/l
C.SO2、SO3均为0.15 mol/l D.SO3为0.4 mol/l
18. 等物质的量的SO2和O2混合, 在一定条件下发生反应, 达到平衡状态时, SO2的转化率为a%, O2的转化率为b%, 则二者的关系为:
A. a% > b% B. a% < b% C. a% = b% D. 不能确定
19.已知某可逆反应在密闭容器中进行.
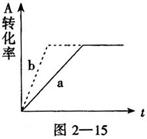 A(g)+2B(g)
A(g)+2B(g) ![]() C(g)+D(s)放出热量,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是
C(g)+D(s)放出热量,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是
A.增大A的浓度 B.缩小容器的容积
C.加入催化剂 D.升高温度
20.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有等体积二氧化氮和空气,现分别进行下列两个实验:①将两容器置于沸水中加热 ②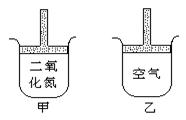 在活塞上都加2千克的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是
在活塞上都加2千克的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.①甲>乙 ②甲>乙 B.①甲>乙 ②甲<乙
C.①甲<乙 ②甲>乙 D.①甲>乙 ②甲=乙翰林汇
二、填空题
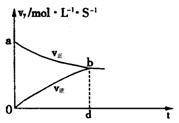
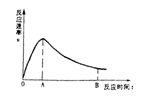 21.现将一定量铁片投入一定量某浓度稀硫酸中,
21.现将一定量铁片投入一定量某浓度稀硫酸中,
测得反应速率V与反应时间关系如右图所示。
OA段速率增大的原因
AB段速率减小的原因
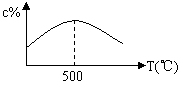 22.某可逆反应A(气)+3B(气)
22.某可逆反应A(气)+3B(气)![]() 2C(气),开始均加入
2C(气),开始均加入
1mol A和3mol B,在各种不同温度下,反应经过相同时间,测得C的百分含量c%与温度的关系如图所示:
⑴ 该正反应是放热反应还是吸热反应_________;
⑵ T<500℃时c%逐渐增大的原因是____________;
 ⑶ T>500℃时c%逐渐减小的原因是________________。
⑶ T>500℃时c%逐渐减小的原因是________________。
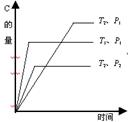
23.可逆反应2A(g)+nB(g)![]() mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下, 测得C的量与时间的关系如右图。
mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下, 测得C的量与时间的关系如右图。
根据图分析,P1、P2的大小关系为 ____________;反应式中系数m和n的关系是__________________; 该反应的逆反应是_____热反应。
![]()
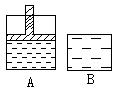 24.有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容,起始时向这两只容器中分别充入等量的体积为2:1的SO2和O2的混合气体,并使A和B容积相等(如图)。在保持400℃的条件下,使之发生如下反应:2SO2+O2 2SO3
24.有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容,起始时向这两只容器中分别充入等量的体积为2:1的SO2和O2的混合气体,并使A和B容积相等(如图)。在保持400℃的条件下,使之发生如下反应:2SO2+O2 2SO3
(1)达到平衡时所需的时间A容器比B容器 ,A容器中SO2的转化率比B容器 。
(2)达到所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡 移动,B容器化学平衡 移动。
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器中SO3的体积分数 (增大、减小、不变),B容器中SO3的体积分数 (增大、减小、不变)。
25.如图,A中有一可自由移动的活塞,关闭开关K,先向B中充入2 mol X和2 mol Y,再向A中充入1 mol X和1 mol Y.起始时A、B的体积都为a L,在相同的温度和有催化剂存在的条件下,两容器中都开始发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g),反应达到平衡时,A的体积为1.2a L,则
2Z(g)+W(g),反应达到平衡时,A的体积为1.2a L,则
![]()
(1)A中X的转化率a (A)=________.
(2)A、B中X的转化率a (A)________ a (B)(填“>”、“<”或“=”).
(3)打开开关K,保持温度不变,再达平衡时,A的体积为________L(连通管中气体体积不计)
26、I. 恒温、恒压下,在一个可变容积的容器中发生如下发应:
![]() A(气)+B(气)
C(气)
A(气)+B(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3 molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol(乙)等于2 mol(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进
行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
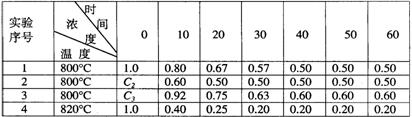
27.某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
三、计算题
28、N2O5是一种白色固体,加热升温时,可迅速气化,并可发生分解反应;
![]()
![]()
![]() ,
,![]()
![]()
![]() ,在0.5L密闭容器中,将2.01molN2O5加热气化,并按上式分解,且在该温度下达到平衡,经过实验测知氧气的平衡溶度为4.4mol/L,N2O3的平衡浓度为1.6mol/L,试计算:
,在0.5L密闭容器中,将2.01molN2O5加热气化,并按上式分解,且在该温度下达到平衡,经过实验测知氧气的平衡溶度为4.4mol/L,N2O3的平衡浓度为1.6mol/L,试计算:
(1)N2O的平衡浓度
(2)N2O5的分解率
(3)平衡时混合气体的平均分子量