高二化学期末模拟试题2
时间:100分钟 分值:120分
命题人:张英
说明:1.请将第Ⅰ卷的答案填涂在答题卡上,在第II卷上直接作答。考试结束后,请上交答题卡和第II卷。
2.本卷可能用到的相对原子质量:H:1 C:12 N :14 O:16 Na :23
Mg:24 A1:27 Si:28 S: 32 C1:35.5 K:39 Ca:40 Fe :56
Cu:64 Br:80
第I卷(选择题 共48分)
一(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化为
A.S2- B.S C.SO32- D.SO42-
2.![]() U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关
U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关![]() U说法正确的是
U说法正确的是
A.![]() U原子核中含有92个中子 B.
U原子核中含有92个中子 B.![]() U原子核外有143个电子
U原子核外有143个电子
C.![]() U与
U与![]() U互为同位素
D.
U互为同位素
D.![]() 23592U与
23592U与![]() U互为同素异形体
U互为同素异形体
3.判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化 B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小 D.金属晶体:晶体是否能够导电
4.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJ/mol
下列说法正确的是
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
5.顺式Pt(NH3)2Cl2(式量为300)是临床广泛使用的搞肿瘤药物。下列有关该物质的说法中正确的是
A.由5种元素组成 B.含有NH3分子
C.Pt的化合价为+4 D.Pt元素的质量百分含量为65%
6.下列物质中有固定沸点的是
A.甘油 B.花生油 C.汽油 D.煤焦油
7.重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组重铬酸铵受热分解产物的判断符合实际的是
A.CrO3+NH3+H2O B.Cr2O3+NH3+H2O C.CrO3+N2+H2O D.Cr2O3+N2+H2O
8.某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是
①分子具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃
③分子中具有12个氢原子的烷烃 ④分子中具有8个碳原子的烷烃
A.①② B.②③ C.③④ D.②④
二(本题包括8小题,每小题3分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
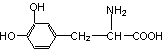 下列关于L-多巴的叙述中错误的是
下列关于L-多巴的叙述中错误的是
A.能与FeCl3溶液发生显色反应 B.不能与盐酸反应
C.能与溴水发生取代反应 D.1mol L-多巴最多可以和3mol NaOH反应
10.下列各组离子能在指定溶液中共存的是
①无色溶液中:K+、Cl-、Na+、H2PO4-、PO43-、SO42-
②使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32-
③水电离的C(H+)=10-12mol/L的溶液中:ClO-、HCO32-.NO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、C6H5O2— 、S2-
A.①③ B.②④⑤ C.①②⑤ D.③⑥
11.纳米材料是指颗粒直径在几纳米至几十纳米的材料。若在某溶剂中纳米材料的颗粒间完全分散开,得到的分散系一定具有的性质是
A.不能透过滤纸 B.难透过半透膜
C.具有丁达尔现象 D.属于溶液,很稳定
12.仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | …… |
| C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | …… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
13.下列说法正确的是
A.文房四宝,做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是蛋白质.石墨.多糖.无机盐;蔗糖.硫酸钡和水分别属于非电解质.强电解质和弱电解质
B.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8;金属元素形成的化合物中,金属元素原子的最外层电子数可能是8
C.将SO2通入品红溶液证明SO2具有漂白性;通入Ba(NO3)2溶液中证明H2SO3具有氧化性和酸性;
D.天然气、沼气和水煤气分别属于化石能源.可再生能源和二次能源
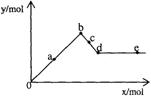 14.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3 溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
14.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3 溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4少
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
15.下列离子方程式正确的是
A.Na投入水中:Na+2H2O=Na++2OH-+H2↑
B.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ = Al(OH)3↓+Al3++H2O
C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42—+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
D.碳酸氢镁溶液中加入足量氢氧化钠:Mg2+ + HCO3ˉ + OHˉ = MgCO3↓+ H2O
16.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.6.2克白磷分子中含P—P键为0.05NA
B.标准状况下,11.2L苯所含分子数为0.5NA
C.6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA
D.1L 0.1mol·L-1的醋酸溶液中有0.1NA个CH3COOH分子
第II卷(非选择题 共72分)
三(本题包括3小题,共38分)
17.(6分)(1)下列实验操作或对实验事实的描述正确的是 (填序号)
①做银镜反应实验的试管在实验前用热碱液洗涤;
②水中含有少量苯和硝基苯,可用活性炭吸附除去;
③ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;
④ 蒸馏石油时,冷凝管中的冷水应上进下出;
⑤准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤压玻璃球,放溶液至21.00mL处;
⑥检验某溶液中含SO42-的操作与现象是:取试样少量,滴加氯化钡溶液有白色沉淀,再加入盐酸,沉淀不消失,可确证其中含有SO42-。
(2)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。______________________________________________________________。
18.(18分).利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
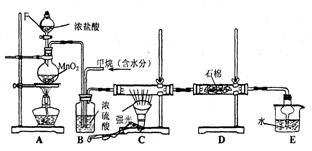
根据要求填空:
(1) B装置有三种功能:①______________;②_________________;③________________;
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是_______________.
(3)D装置中的石棉上均匀附着KI粉末,其作用是__________________________
(4)E装置的作用是____________(填编号);
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_____________________________________
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为____________。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是______________(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
19.(14分)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
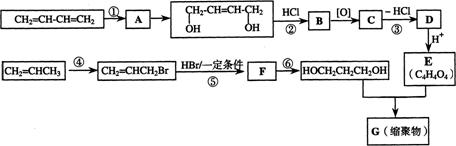
请完成下列各题:
(1)写出反应类型:反应① 反应④
(2)写出反应条件:反应③ 反应⑥
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式
四(本题包括2小题,共20分)
20.(10分)已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O化学计量数a~k均为正整数)。回答下列问题:
(1) 根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)
(2) 根据反应中离子的电荷守恒,可得b、c、d、f的关系式是
(3) 根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
(4) 若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;c的取值范围是 。
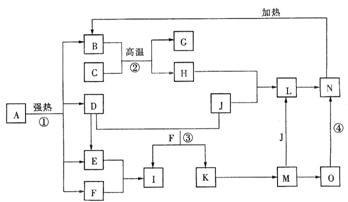 22.(10分)仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。
22.(10分)仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。
请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A分解的化学方程式为______________________。
(2)写出反应②在工业生产上的一种用途__________________________。
(3)反应③的离子方程式为_______________________________________;
反应④的化学方程式为________________________________________________。
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是__________ ___。
五(本题共2小题,共14分)
19.(7分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知溶液的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6+I2 C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol/LCH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中,加入1mL淀粉指示剂,立即用浓度为0.05000mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
24.(7分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3 = NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3 = 2NaNO2+CO2↑ ②
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用纯碱溶液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
①若该混合气体通入纯碱溶液时要求被完全吸收,则x的取值范围应为 。
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×106m3(标准状况)含NOx(x取值范围满足①中要求)体积分数为0.1%的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式。