高二化学第一学期期中考试试题9
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共8页,满分150分,考试时间120分钟。
注意事项:
1.答第Ⅰ卷前,考生必将自己的姓名、考号、考试科目用2B铅笔涂写在答题卡上。
2.非选择题在答卷上作答。
3. 可能用到的相对原子质量: C:12 O:16 Ca:40
第Ⅰ卷(选择题 共64分)
一、选择题(本题共包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列说法不正确的是
A.焓变是一个反应能否自发进行的相关因素,多数放热反应能自发进行
B.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.能自发进行的反应一定能迅速进行
D.一个反应能否自发进行,与焓变和熵变的共同影响有关
2.反应N2+O2 ![]() 2NO 在密闭容器中进行,下列不能加快反应速率的条件是
2NO 在密闭容器中进行,下列不能加快反应速率的条件是
A. 缩小体积,增大压强
B.体积不变,充入N2使压强增大
C. 体积不变,充入氦气使压强增大
D.体积不变,充入NO使压强增大
3.下列化合物分子中不含π键的是
A.二氧化碳 B.乙醇 C.甲酸 D.葡萄糖
4.下列说法正确的是
A. 同一原子中,2p、3p、4p能级轨道数依次增多
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.处于最低能量的原子叫做基态原子
5. 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+1/2 O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.1/2 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
6.下列含有极性键的非极性分子是
①BF3 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2S ⑦SO2 ⑧CS2 ⑨H2O ⑩HF
A.②③④⑤⑧ B.①③④⑤⑧
C.①③④⑧ D.以上均不对
7.下列说法不正确的是
A.金刚石的摩氏硬度最大但是用铁锤击打易破碎。
B.电气理论可理解为金属元素的最外层的电子脱落原子的束缚,形成“自由电子”从而电子在金属阳离子之间自由移动。
C.晶格能越大晶体越容易从岩浆中析出。
D.任何的分子晶体都有分子密堆积的特征。
8.某元素M的单质1.8g在过量的O2中充分燃烧,得到M2O33.4g,已知M原子核外电子数比核内中子数少1。该元素在周期表中的位置是
A.第2周期ⅢA族 B.第2周期ⅥA族
C.第3周期ⅤA族 D.第3周期ⅢA族
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列表示物质的电子式正确的是
![]()
![]() A.二硫化碳 B、硫化氢
A.二硫化碳 B、硫化氢
![]() C.氮气
C.氮气 ![]() D.过氧化钠Na+[
]2- Na+
D.过氧化钠Na+[
]2- Na+
10.关于晶体的下列说法正确的是
A.只要含有金属元素的晶体就一定是离子晶体
B.离子晶体中一定含金属阳离子
C.在共价化合物分子中各原子都形成8电子结构
D.分子晶体的熔点不一定比金属晶体熔点低
11. 根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是
| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2300℃ |
A.SiCl4是分子晶体
B.MgCl2中键的强度比NaCl中键的强度小
C.单质可能是原子晶体
D.AlCl3为离子晶体
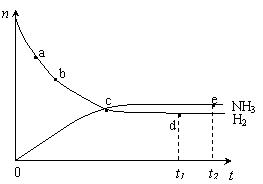 12.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
12.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),△H<0。673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),△H<0。673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
13.下列物质性质的变化规律,与共价键的键能大小有关的是
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
14.2001年3月发现硼化镁在39 K时呈超导性,
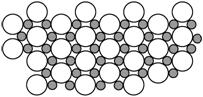 可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为
A.MgB B.MgB2 C.Mg2B D.MgB
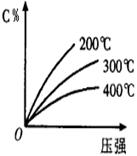 15.反应mA(固)+nB(气)
15.反应mA(固)+nB(气) ![]() pC(气)+qD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图,下列叙述正确的是
pC(气)+qD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如右图,下列叙述正确的是
A.到平衡后,加入催化剂则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中m+n < p+q
D.达到平衡后,增加A的量有利于平衡向右移动
16. 同在室温下,同种规格的铝片分别与下列物质混合,开始时化学反应速率最大的是
A.0.05mol/L的盐酸10mL
B.0.1mol/L的盐酸10mL
C.0.1mol/L的硫酸溶液10mL
D.18mol/L的浓硫酸 10mL

第Ⅱ卷(非选择题,共86分)
三、填空题(本题包括2小题,共18分)
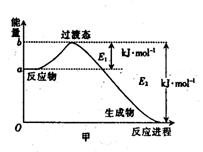 17. (10分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
17. (10分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
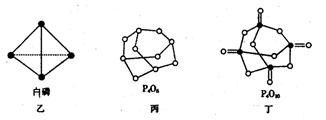
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol—1 | 198 | 360 | 498 | X |
已知白磷(P4)的燃烧热为2982 kJ·mol—1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
18.(8分)在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①O2的转化率为
②平衡时容器内气体总物质的量为 mol;
③平衡时体系中SO3的百分含量(体积分数)为 ;
④若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
四、填空题(本题包括2小题,共32分)
19.(12分)(1)化学平衡常数K表示可逆反应的进行程度,K值大小与温度有关,关系是:温度升高,K值___________ __ 。
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
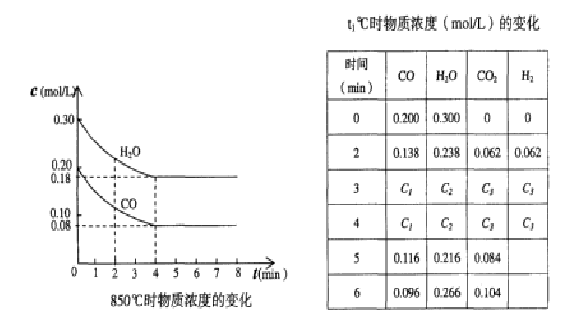 CO(g)十H2O(g)
CO(g)十H2O(g) ![]() CO2(g)十H2 (g);(正反应放热)。CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=__ ____ mol/(L·min)
CO2(g)十H2 (g);(正反应放热)。CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=__ ____ mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态;(填“平衡”或“不平衡”)C1数值_________0.08 mol/L (填“大于”、“小于”或“等于”)。
②反应在4min—5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
20.(20分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A在元素周期表中的位置____ ___________。
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是__________ (填写离子符号)。
⑶CA2与D元素的单质在水溶液中反应的离子方程式是___________________。
⑷C元素常见的化合价有—2、+2、+4、+6等,请你大胆猜想,写出C与D形成各原子最外层都满足8电子稳定结构的两种化合物的化学式 _______________、
(5)写出C元素基态的价电子排布式
(6)写出A元素基态的电子排布式
(7)用电子式表示A、B形成稳定化合物的过程
(8)A的电负性 C的电负性,A的第一电离能 C的第一电离能(填“大于”、“小于”、“等于”)
五、填空题(本题包括2小题,共18分)
21.(8分) PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是 结构(填“平面正方形”或“ 四面体”)
(2)淡黄色固体物质是由 分子组成,黄绿色固体物质是由 分子组成(填“极性分子”或“非极性分子”)
(3)黄绿色固体在水中溶解度比淡黄色固体大,原因是
。
22.(10分)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1).在周期表中,最可能处于同一族的是( )
A .Q和R B.S和T C.T和U D.R和U
(2).发生还原反应时,下列转化最有可能的是( )
A.U2++2e-→U B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T
(3).它们的氯化物的化学式,最可能正确的是( )
A.QCl2 B.RCl C.SCl3 D.TCl
(4).S元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素
(5).下列元素中,化学性质和物理性质最像Q元素的是( )
A. 氦(1s2) B.铍(1s22s2) C.锂(1s22s1) D.氢(1s1)
六、计算题(本题包括2小题,共18分)
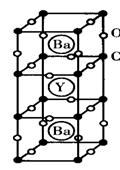 23.(8分)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。(白球代表O原子,黑球代表Cu原子)
23.(8分)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。(白球代表O原子,黑球代表Cu原子)
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数,确定其化学式。(写出每个原子的计算过程)
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为Y+3,Ba+2,Cu+2和Cu+3)试计算化合物中这两种价态Cu原子个数比。
24.(10分)在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比。