高二化学第一学期期中考试试题(理科)2
本试卷分为第I 卷(选择题)和第II卷(非选择题)两部分
试题总分值:100分 考试时间:90分钟
可能用到的相对原子质量: H: 1 N: 14 O: 16 Mg :24 Al:27 Fe:56 Cu: 64 Zn: 65
一、选择题(本题共22小题,每小题2分,共44分。每小题只有一个选项符合题意)
1.实验室制取下列气体时,与制取氨气的装置相同的是
A.NO B. O2 C.Cl2 D.NO2
2.下列事实可证明氨水是弱碱的是
A.0.1mol·L-1氯化铵溶液的pH约为5
B.0.1mol·L-1氨水可以使酚酞试液变红
C.铵盐受热易分解
D.少量氨水能跟氯化铝溶液反应生成氢氧化铝
3.在2A+B ![]() 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.v(A) = 0.5mol·L-1·S-1 B.v(B) = 0.3 mol·L-1·S-1
C.v (C) = 0.8mol·L-1·S-1 D.v (D)= 1 mol·L-1·S-1
4.Murad等三位教授最早提出NO分子在人体内有独特功能而获1998年诺贝尔奖,关于NO的下列叙述,不正确的是
A.NO可以是某些低价N物质氧化的产物
B.NO不是亚硝酸酐
C.NO是红棕色气体
D.NO可以是某些高价N物质还原的产物
5.在KHSO4的极稀溶液和熔融状态下都存在的离子是
A.H+ B.HSO4-
C.SO42- D.K+
6.工业制镁粉时,需将镁粉蒸气进行冷却,冷却最好在下列哪些物质中进行
A.空气 B.氮气
C.二氧化碳 D.氢气
7.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是
A.2NO+O2![]() 2NO2
B.N2O4
2NO2
B.N2O4![]() 2NO2
2NO2
C.Br2(g)+H2![]() 2HBr D.6NO+4NH3
2HBr D.6NO+4NH3![]() 5N2+3H2O
5N2+3H2O
8.在同一温度下,若弱电解质溶液a,强电解质溶液b,二者的导电能力相同,当升高温度后,它们的导电能力将是
A.a>b B.a=b C.b>a D.无法确定
9.下列离子方程式正确的是
A.HCO3-+H2O
= H2CO3+OH- B.Al3++3H2O ![]() Al(OH)3+3H+
Al(OH)3+3H+
C.2Al3++3CO32-
![]() Al2(CO3)3↓ D.Br-+H2O
Al2(CO3)3↓ D.Br-+H2O
![]() HBr+OH-
HBr+OH-
10.在下列物质中,硝酸既显示氧化性,又显示酸性的是 ( )
A、氧化铜与稀HNO3 B、铜与稀HNO3
C、碳与浓HNO3 D、Cu(OH)2与HNO3
11.在由水电离产生的[H+]=1×10-14mol·L-1的某无色溶液中一定能大量共存的是
A.Fe2+、K+、SO42-、NO3- B.Mg2+、NH4+、SO42-、Cl-
C.Na+、K+、SO42-、NO3- D.Ba2+、Na+、SO42-、MnO4-
12.反应2SO3(g) ![]() 2SO2(g)+O2(g);(正反应吸热反应)在一密闭容器中进行,对反应进程的描述有如下四个图象,其中正确的是(y表示SO2的含量)
2SO2(g)+O2(g);(正反应吸热反应)在一密闭容器中进行,对反应进程的描述有如下四个图象,其中正确的是(y表示SO2的含量)
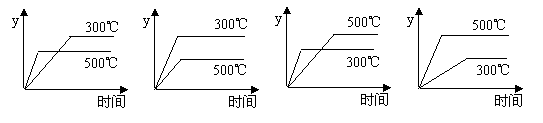
A B C D
13.将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液中离子浓度关系正确的是
A.c(NH+4)>c(Cl-)>c(H+)>c(OH-) B.c(NH+4)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH+4)>c(H+)>c(OH-) D.c(Cl-)>c(NH+4)>c(OH-)>c(H+)
14.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。
下列说法正确的是
A、同物质的量浓度的三种溶液的pH:a>b>c
B、同pH时,三种溶液稀释相同倍数后,pH:a=b>c
C、同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
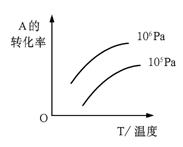 15.在不同的压强、温度下,下列化学平衡体系中: mA(g)+nB(g)
15.在不同的压强、温度下,下列化学平衡体系中: mA(g)+nB(g) ![]() pC(g)+qD(g) 物质A的转化率如右图所示,据此,对该反应的推论正确是
pC(g)+qD(g) 物质A的转化率如右图所示,据此,对该反应的推论正确是
A.正反应是吸热反应,(m+n)>(p+q)
B.正反应是吸热反应,(m+n)<(p+q)
C.正反应是放热反应,(m+n)>(p+q)
D.正反应是放热反应,(m+n)<(p+q)
16.在Na2CO3溶液中,各种离子的物质的量浓度关系错误的是
A.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
C.c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
17.用等质量的钠进行下列实验,其中生成氢气最多的是
A.将Na投入足量的水中
B.将Na用铝箔包好并刺一些小孔,再放入足量水中
C.将Na投入足量稀硫酸中
D.将Na投入足量稀盐酸中
18.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到1.12L(标准状况下)气体,则所消耗硝酸的物质的量是 ( B )
A、0.12mol B、0.11mol C、0.09mol D、0.08mol
19.下列颜色的变化不能用勒沙特列原理解释的是( )
A.红棕色NO2加压后颜色先变深,后逐渐变浅。
B.在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深。
C.FeCl3溶液加热后颜色变深。
D.及时分离从合成塔中出来的混合气,有利于合成氨
20.pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积
比是
A.11∶1 B.9∶1 C.1∶11 D.1∶9.
21.常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(CH3COO-)<c(Na+) B.c(CH3 COO-)>c(Na+)
C.c(CH3COO-)=c(Na+) D.无法确定c(CH3 COO-)与c(Na+)的关系
22.在一个密闭容器中,充入3 mol A和1 mol B,发生如下反应:
3A(g)+B(g) ![]() 2C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器的压强和温度不变,按下列四种方法改变起始物质的用量,达到平衡后,C的浓度仍为W mol·L-1的是:
2C(g)+D(g),达到平衡时,C的浓度为W mol·L-1。若维持容器的压强和温度不变,按下列四种方法改变起始物质的用量,达到平衡后,C的浓度仍为W mol·L-1的是:
①1 mol B+2 mol C+1 mol D ②3 mol A+1 mol B+2 mol C
③6 mol A+2 mol B ④2 mol C+1 mol D
A.①② B.③④ C.②③ D.只有④
二、填空题(本题共2小题,共16分)
23、(本题8分)在密闭容器中的可逆反应CO(g)+NO2(g) ![]() CO2(g)+NO(g);正反应是放热反应,达到平衡后:
CO2(g)+NO(g);正反应是放热反应,达到平衡后:
(1)扩大容器体积,平衡______,(填“变大” “变小”或“不变” )反应混合物的颜色变______。(填“深”“浅)
(2)升高温度平衡______。(填“向左”“向右” 或“不” )
(3)加入催化剂,NO的物质的量______。(填“变大” “变小”或“不变” )
24、(本题8分)某化工厂生产中要用到一种无色、可溶于水的晶体——铝铵矾,该晶体是一种复盐,其主要化学成分是硫酸铝铵——NH4Al(SO4)2,向该盐的浓溶液中加入浓KOH溶液,将发生一系列变化,试求:
A.硫酸铝铵在水中电离的方程式:
B.在逐渐加入浓KOH溶液的过程中,产生的现象依次是:①溶液中出现白色沉淀,白色沉淀量逐渐增多 ②有刺激性气味的气体放出 ③白色沉淀量逐渐减少,白色沉淀完全消失,请依次写出滴入KOH溶液过程中发生的化学反应的离子方程式:
①
②
③
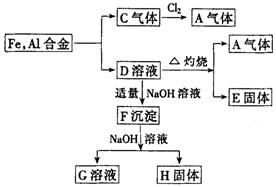 三、推断题(本题共1小题,共8分)
三、推断题(本题共1小题,共8分)
25.(8分)从铁、铝合金出发的反应如图:
试确定A,C,G,的化学式:
A________________, C____________,
G________________,
写出C气体和Cl2反应的化学方程_________________________________________
四、实验题(本题共2小题,共20分)
26.(6分)下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
(1)其中标出仪器使用温度的是 (填写编号);
(2)能够用以精确量取液体体积的是 (填写编号);
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 。
27.(14分)(1)在酸碱中和滴定实验中,在中和滴定之前盛标准液的滴定管有如下几步操作:①润洗 ②洗涤 ③调液面 ④读数 ⑤注液
合理顺序是
(2)用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列实验操作会引起测量结果偏高的是 。(填代号)
A.用天平称量NaOH固体,将试剂放在右盘,砝码放在左盘,并移动游码便之平衡;
B.配制烧碱溶液时,将称量后的NaOH固体溶于水后,立即移入容量瓶并将洗涤液也转入容量瓶,再加蒸馏水到刻度线
C.中和滴定时,锥形瓶内有少量水
 D.酸式滴定管用蒸馏水洗后,未用标准溶液洗
D.酸式滴定管用蒸馏水洗后,未用标准溶液洗
E.读取滴定终点时,仰视刻度线
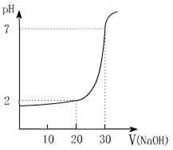
(3)右图为10ml一定物质的量浓度的盐酸X用一定浓度的NaOH溶液Y滴定的图示,依据图示和表中的数据
推出X和Y的物质的量浓度可能是( )
| A | B | C | D | |
| X物质的量浓度 (mol·L-1) | 0.12 | 0.04 | 0.03 | 0.09 |
| Y物 质的量浓度 (mol·L-1) | 0.04 | 0.12 | 0.09 | 0.03 |
(4)常温下用0.05 mol·L-1盐酸测定某知浓度的Ba(OH)2溶液,实验数据如下表所示
| 实验编号 | 待测Ba(OH)2溶液的体积(ml) | 滴入0.05mol·L-1HCl体积(ml) |
| 1 | 10.00 | 20.02 |
| 2 | 10.00 | 19.98 |
| 3 | 10.00 | 20.00 |
则Ba(OH)2溶液的pH为 .
五、计算题(本题共1小题,共12分)
28.将一定量的镁铝合金投入100mL一定浓度的盐酸中,合金全部溶解,向所
 得溶液中滴加5mol/L的氢氧化钠溶液体积的关系如下图所示:
得溶液中滴加5mol/L的氢氧化钠溶液体积的关系如下图所示:
由图中数值计算:
(1)合金中镁的质量分数;
(2)合金中镁、铝物质的量之比;
(3)所用盐酸的物质的量浓度。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| B | A | B | C | D | D | C | A | B | B | C |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| D | B | A | A | A | B | B | B | D | C | B |
23、(1)不 浅 (2)向左 (3)不变
24、A 、NH4Al(SO4)2=NH4++Al3++SO42-
B、①Al3++3OH-=Al(OH)3↓ ②NH4++OH-=NH3↑+H2O
③Al(OH)3+OH-=AlO2-+2 H2O
25、A HCl C H2 G NaAlO2 H2+Cl2=2HCl
26、(1)abc (2)c (3)9.5g
27、(1)②①⑤③④ (3分) (2)B、D、E (3分)
(3)D (4分) (4)13 (4分)
28、⑴ 64% ⑵ 2:1 ⑶ 8mol/L