高二化学第一节 甲烷
【教学目标】
1、理解有机物的概念和有机物的特点
2、掌握烃的概念、甲烷的组成和分子结构
3、掌握甲烷的物理性质和化学性质
4、掌握取代反应的概念
【知识讲解】
一、有机物
1、有机物的概念:
含碳元素的化合物称有机化合物,简称有机物。而一氧化碳、二氧化碳、碳酸、碳酸盐等少数含碳物质,虽然含有碳元素,但它们的组成和性质跟无机物相近,一般把它们作为无机物。
2、有机物的特点:
(1)组成元素的特点:除碳元素外,通常还含有H、O、N、P、S,及卤素等非金属元素。
(2)结构特点:
①碳原子间能以共价键形成碳链,这是有机物结构的基础。
②有机物分子间通过范德力结合成分子晶体。
(3)数量特点:
有机物种类繁多,达上千万种。原因是:
①碳原子有4个价电子,能与其它原子形成4个共价键。
②碳链的长度可以不同,同时碳原子间的结合方式不同,可以以单键、双键、参键结合,
也可以有长链或环状结合。
③普遍存在同分异构现象。
(4)性质特点:
①溶解性:大多数有机物难溶于水,易溶于有机溶剂(如汽油、酒精、苯等)。
②可燃性:绝大多数有机物易燃烧。
③耐热性:多数有机物熔点沸点较低,受热易分解。
④导电性:多为非电解质,不易导电。
⑤化学反应:化学反应繁杂,一般反应速率较慢,多数需要催化剂,常伴有副反应发生。
二、甲烷的分子结构和物理性质:
1、甲烷的物理性质:
通常情况下,无色无气味的气体,密度比空气小,难溶于水。
甲烷存在于沼气、坑气、天然气。
2、![]()
|
![]() 分子式:CH4, 电子式:H:C:H 结构式H-C-H
分子式:CH4, 电子式:H:C:H 结构式H-C-H
H H
正四面体结构 键角109028![]()
3、确定有机物分子式和结构式的基本方法
(1) 各元素的质量
各元素的质量
(2)![]()
![]()
![]() 各元素的质量比
各元素的质量比
![]() 最简式
通式计算
最简式
通式计算
(3)![]()
![]() 各元素的质量分数
讨论
各元素的质量分数
讨论
(4)燃烧产物的物质的量或质量
![]()
![]() 分子式 性质 结构式
分子式 性质 结构式
(1)![]()
 M=22.4d
M=22.4d
(2)![]()
![]()
![]() M=DMr(D为相对密度, M
M=DMr(D为相对密度, M ![]() 相对分子
根据化学方程式
相对分子
根据化学方程式
![]() r为气体相对分子质量)
质量
计算、讨论
r为气体相对分子质量)
质量
计算、讨论
(3)M=M1a%+ M2a2%+……
例1:在标准状况下,5.6L某气态烃的质量为4g,又知该烃中碳与氢的质量比为3:1。求该烃的分子式。
解析:该气态烃的摩尔质量为:![]()
1mol该气态烃中碳的物质的量为:![]()
1mol该气态烃中氢的物质的量为:![]()
即1mol该气态烃中,含1mol C和4mol H,所以分子式为CH4。
三、甲烷的实验室制法
(1)药品:无水醋酸钠(CH3COONa)和碱石灰
(2)![]()
![]() 原理:CH3-COONa+NaO -H △ Na2CO3+CH4↑
原理:CH3-COONa+NaO -H △ Na2CO3+CH4↑
CaO
(3)![]() 发生和收集装置:该反应为“固+固 △ 气”应与制备O2、NH3发生装置相同。使用排水法收集。
发生和收集装置:该反应为“固+固 △ 气”应与制备O2、NH3发生装置相同。使用排水法收集。
(4)说明:(1)实验室制甲烷时不能用醋酸钠晶体(CH3COONa·3H2O),而必须用无水醋酸钠,因为有水存在时,CH3COONa和NaOH都是离子化合物发生电离,不能使CH3COONa中C-C和NaOH中O-H键的断裂,因而不能制得甲烷。(2)碱石灰的作用:制备甲烷时,碱石灰中的生石灰并不参加反应,但生石灰起如下作用:①稀释混合物的浓度,使混合物疏松,使生成的甲烷易于外逸;②减少了固体NaOH在高温时跟玻璃的作用,防止试管破裂;③生石灰吸水性强,可以减少水对制备甲烷反应的不利影响。
四、甲烷的化学性质
甲烷分子结构稳定,通常不与强酸、强碱或强氧化剂反应,不能使溴水和KMnO4溶液褪色。1、氧化反应:
![]() CH4+2O2 点燃 CO2+2H2O
CH4+2O2 点燃 CO2+2H2O
注意:(1)点燃甲烷之前须检验甲烷的纯度。(2)燃烧前后气体体积变化,当温度高
于1000C,反应前后气体体积不变化;低于1000C,每1体积CH4完全燃烧,气体体积缩小2体积。
2、取代反应:
![]() CH4+Cl2 光 CH3Cl+HCl
CH4+Cl2 光 CH3Cl+HCl
CH3Cl能逐步被Cl2取代生成CH2Cl2、CHCl3和CCl4。
注意:(1)反应条件:光照(在室温暗处不发生反应);(2)反应物:纯卤素,如甲烷通入溴水中不反应;(3)产物:一般是混合物。
例2:甲烷与F2光照时因剧烈反应易发生爆炸。为了制取CH3F,常用BrF与CH4在光照条件下反应,请写出制取CH3F的化学方程式。
![]() 解:CH4+BrF 光照 CH3F+HBr
解:CH4+BrF 光照 CH3F+HBr
比较取代反应与置换反应:
| 取 代 反 应 | 置 换 反 应 | |
| 概 念 | 有机物分子里的原子或原子团被其它原子或原子团所代替的反应 | 一种单质和一种化合物反应生成另一种单质和另一种化合物的反应 |
| 反应物类别 | 化合物与单质或化合物 | 单质与化合物 |
| 生成物类别 | 两种化合物 | 一种单质和一种化合物 |
| 反应条件 | 大多需加热或光照或催化剂 | 一般在常温或加热条件下 |
|
| CH4+Cl2 光照 CH3Cl+HCl | Zn+H2SO4=ZnSO4+H↑ |
3、高温分解:
![]() CH4 高温 C+2H2(制取炭黑)
CH4 高温 C+2H2(制取炭黑)
例3:甲烷在空气中的爆炸极限是含甲烷5%-15%,如果在相同状况下,1L甲烷与空气中氧气混合点燃使之恰好完全反应,则此时( )
A、会引起爆炸 B、不会引起爆炸
C、加热时才能爆炸 D、加压时才能爆炸
![]() 解析:甲烷与O2完全反应:CH4+2O2 点燃 CO2+2H2O
解析:甲烷与O2完全反应:CH4+2O2 点燃 CO2+2H2O
1LCH4燃烧需2L O2,即需空气V空气=![]() =9.5L。
=9.5L。
所以甲烷占混合气体的体积分数为![]() 。
。
 正好在5%-15%爆炸极限内,点燃会引起爆炸,则选A。
正好在5%-15%爆炸极限内,点燃会引起爆炸,则选A。
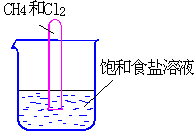
例4:把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是:
(1)___________________(2)__________________
(3)___________________(4)__________________
解析:CH4和Cl2光照生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl
等物质,随着Cl2不断消耗,黄绿色逐渐消失,又由于CH2Cl2、CHCl3、CCl4常温下为无色液体,Cl2易溶于有机溶剂,试管壁上有黄色油珠。因生成的HCl易溶于水,反应后试管内气体压强减小,水位在试管内上升。HCl溶于水后,饱和食盐水中Cl-浓度增大,使结晶速率>溶解速率。故水槽内有少量晶体析出。
答:(1)黄绿色逐渐消失;(2)试管壁上有黄色油珠;(3)水位在试管内上升;(4)水槽内有少量晶体析出。
【能力训练】
一、选择题(每小题有1-2个选项符合题意)
1、下列物质具有导电性的是
A、汽油 B、稀硫酸 C、苯 D、四氯化碳
2、某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1:1,由此可以得
出该有机物
A、分子中C、H、O的原子个数比为1:2:3
B、分子中C和H的原子个数比为1:2
C、分子中肯定含有氧原子
D、分子中可能含有氧原子
![]() 3、化学工作者从反应C2H6+Cl2 光 C2H5Cl+HCl,受到启示,提出在农药和有机工业上
3、化学工作者从反应C2H6+Cl2 光 C2H5Cl+HCl,受到启示,提出在农药和有机工业上
可获得副产品盐酸,这一设想已成为现实。试指出上述反应体系中,得到的盐酸可采用分离方法是
A、蒸馏法 B、水洗法 C、分液法 D、过滤法
4、将醋酸钠晶体(CH3COONa·3H2O)与干燥的碱石灰按一定的质量比混合后加热,几
乎没有得到甲烷气体。此次实验失败的原因是
A、用了醋酸钠晶体,应该用无水醋酸钠
B、加热的温度不够高
C、不能按质量比将反应物混合
D、碱石灰过于干燥,实验效果反而不好
5、下列反应属于取代反应的是
A、甲烷的燃烧 B、由甲烷制取氯仿
C、甲烷的制取 D、由甲烷制取炭黑
6、有3mL CH4和CO的混合气体,完全燃烧恰好用去3mL O2,则此混合物体中CH4和CO的体积比是
A、1:1 B、1:2 C、2:1 D、任意比
7、一定质量的甲烷燃烧后得到的CO、CO2和水蒸气,此混合气质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g。原混合气体中CO2的质量为
A、12.5g B、13.2g C、19.7g D、24.4g
8、甲烷与过量氧气混合,用电火花引爆后,测得爆炸后的气体密度为同温同压下氢气密度的15倍,(T>1000C)则原混合气体中甲烷与氧气的体积比是
A、1:3 B、1:5 C、1:7 D、2:7
|
A、25% B、50% C、75% D、80%
10、某容器中贮有甲烷和氧气的混合气体,测得混合气体中含碳的质量分数是10.7%,将此混合气体引燃后冷却到室温,则容器中所含气体是
A、CO2 B、CO2和O2 C、CO2和水蒸汽 D、CO2和CH4
11、若使0.5mol甲烷和Cl2发生取代反应并生成相同物质的量的四种取代物,则需氯气的物质的量是
A、0.5mol B、1.25mol C、2mol D、2.5mol
12、同时符合以下要求的实验条件所能制取的气体是
①干燥 ②使用药品不能带有结晶水 ③加热 ④使用排水法收集
A、CO2 B、Cl2 C、CH4 D、HCl
二、填空题
13、解释:(1)CCl4能从碘的水溶液中萃取出碘:________________________________。
(2)衣服上沾上了油渍可以用汽油洗去___________________________________________。
14、某盐A和碱石灰反应,微热时放出一种气体B,再经强热又放出一种气体C。同温同压下,气体B和C密度接近,余下的残渣中加入硝酸,又有一种气体D放出。气体D通过一种淡黄色的固体可得到一种气体E。
(1)写出有关物质的化学式:A_____________,B___________,C______________。
(2)写出气体D转变为E的化学方程式为___________________________________。
15、已知某种气态矿物燃料含有碳和氢两种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置中,得到如下表所列的实验结果(假设产生的气体完全被吸收)。
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
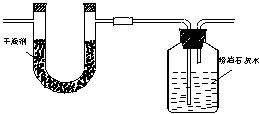 |
根据实验据回答下列问题:
(1)实验完毕后,生成水的质量为________g,假设广口瓶里盛有足量的澄清石灰水,则生成的CO2质量为________g.
(2)气态矿物燃料中碳元素与氢元素的质量比为____________.物质的量比__________
16、为了测定一种气态烃A的化学式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气,学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的最简式。他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排尽):
![]()
![]()
![]() 甲方案:燃烧产物 浓H2SO4 增重 碱石灰 增重 点燃 生成CO2
甲方案:燃烧产物 浓H2SO4 增重 碱石灰 增重 点燃 生成CO2
2.52g 1.32g 1.76g
![]()
![]()
![]() 乙方案:燃烧产物 碱石灰 增重 灼热Cu2O
减轻 石灰水 增重
乙方案:燃烧产物 碱石灰 增重 灼热Cu2O
减轻 石灰水 增重
5.60g 0.64g 4g
试回答:(1)根据两方案,你认为哪一种方案能求出A的最简式?________,A的最简式为_________。(2)若要确定A的化学式,是否还需要测定其它数据?_________如果需要,该测定哪些数据?______________________。
三、计算题
17、在t℃(t>100℃),某气态烃与过量氧气的混合气体aL,引燃后再恢复到原来条件,体积仍为aL,然后通过浓硫酸,体积减少bL,再通过碱石灰,气体体积又减少bL,求该气态烃的化学式。
18、甲、乙两学生用加热无水醋酸钠和碱石灰的混合物制取甲烷,甲取了一定量的无水醋酸钠和5g 碱石灰(其中含NaOH的质量分数为60%),经混合装入试管内加热,待收集到所需的甲烷时,停止加热,试管冷却后,乙称得甲留下的反应混合物的质量为8.7g,并将它继续加热到醋酸钠完全反应,收集到甲烷560mL(标准状况),求甲在标准状况下收集到甲烷的体积?
【能力训练答案】
一、 选择题:
1、B 2、BD 3、B 4、A 5、BC 6、B 7、B
8、C 9、C 10、B 11、B 12、C
二、 填空题:
13、(1)CCl4不溶于水,且碘在CCl4中溶解性比在水中要大;
(2)油脂易溶于汽油中。
14、(1)CH3COONH4,NH3,CH4; (2)2CO2+2Na2O2=2Na2CO3+O2
15、(1)1.8g, 2.2g; (2)3:1,1:4
16、(1)甲,CH4; (2)不需要,该化学式就是最简式。
17、C2H4
18、560mL