高二化学第一学期期末试题
第一卷 (选择题共72分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27
C1 35.5 Mg 24 Fe 56 Zn 65
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.用NaOH标准溶液测定未知浓度的盐酸溶液时,在观察消耗碱量时初读数平视刻度,末读数45O俯视刻度线,其它操作均正确。计算所得盐酸的浓度比实际的浓度
A.偏大 B.偏小 C.无误差 D.无法确定
2.用铝热法还原下列化合物,制得金属各1mol需消耗铝的量最少的是
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
3. 燃料电池是目前的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:
x 极:O2(g) + 2H2O(l) + 4e- → 4OH- y极:2H2(g)-4e- +4OH-→ 4H2O(l)
判断下列说法中正确的是
A.x极发生氧化反应 B.x极是负极
C.y极发生氧化反应 D.电子由x极流向y极
4.在水电离出的c(H+)=10-13mol/L的溶液中,一定能大量共存的离子组是
A.K+、Na+、HCO3-、Cl- B.K+、AlO2-、Br-、Cl-
C.Na+、NO3-、SO42-、Cl- D.Fe2+、NH4+、SO42-、NO3-
5.pH=10的醋酸钠和氨水溶液中,水的电离程度关系前者与后者比较
A.大于 B.小于 C.等于 D.无法确定
6.A、B、C、D四种金属,已知A与C组成的原电池中C为正极;A放入B的盐溶液中可把
B置换出来;电解含有B离子和C离子的混合溶液时,B离子先放电;D与B组成的原电池中电流从D流向B。则四种金属活动性
A.A >B>C>D B.A>C>B>D
C. A>C>D>B D.D>C>A>B
7.有机物
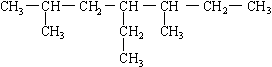 的名称是
的名称是
A.4—乙基—3,5—二甲基庚烷 B.2,5—二甲基—4—丙基己烷
C.2,5—二甲基—4—乙基庚烷 D.1,1,4—三甲基—3—乙基己烷
8.在电解水制氢气时,为了增强导电性,常常要加入一些电解质,最好选用下列物质中的
A.NaOH B.HC1 C.NaCl D.CuSO4
二、选择题(本题包括12小题,每小题4分,共48分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.在N2+3H2![]() 2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,
2NH3的平衡体系中,保持容器的体积和温度不变,充入氩气以增大压强,
此时下列叙述正确的是
 A.正反应速率和逆反应速率均增大,平衡向正反应方向移动
A.正反应速率和逆反应速率均增大,平衡向正反应方向移动
B.正反应速率和逆反应速率都没有变化,平衡也不移动
C.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
D.正反应速率增大,逆反应速率增大, 平衡不移动
10.下列某种烷烃与氯气发生取代反应时,只能生成一种一氯代物,则该烷烃的分子式是
A.C2H6 B.C6H14 C.C5H12 D.C7H16
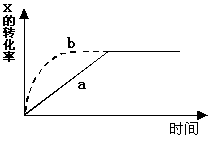 11.一定温度下,曲线a表示反应
11.一定温度下,曲线a表示反应
2 X(g) + Y(g) ![]() Z(g) +2 M(g) + N(s)
Z(g) +2 M(g) + N(s)
(正反应为放热反应) 进行过程中X的转化率
随时间变化的关系。 若要改变起始条件,使反应
过程按b曲线进行,可采取的措施是
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大压强
12.一种分子式为C200H196的含多个碳碳叁键(-C≡C-)的链状烃,其分子中含碳碳叁键最多可以是
 A.52个 B.50个
C.98个 D.51个
A.52个 B.50个
C.98个 D.51个
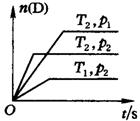
13.可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)在温度T1、T2,压强p1、
pC(g)+qD(g)在温度T1、T2,压强p1、
p2下,产物D的物质的量n与反应时间 t的关系如右图所示。
下述各项中不正确的是
A.T1<T2 B. p1<p2
C.正反应为放热反应 D.m+n<p+q
14.两种气态烃组成的混合物共0.1mol,完全燃烧后得到3.85LCO2(标准状况)和3.6g水,下列说法正确的是
A.一定有甲烷 B.一定有乙烷 C.一定有乙烯 D.一定有乙炔
15.由锌、铁、铝、镁四种金属中的两种组成的混合物10g与足量的盐酸反应产生的氢气在
标准状况下为11.2L,则混合物中一定含有的金属是
A.锌 B.铁 C.铝 D.镁
16. 下列各反应离子方程式中,属于水解反应的是
A.NH4++H2O![]() NH3·H2O+H+ B.HCO3-+OH-
NH3·H2O+H+ B.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
C.HCO3-+H2O![]() H3O++CO32- D.HS-+H2O
H3O++CO32- D.HS-+H2O![]() H2S+OH-
H2S+OH-
17.苯的同系物的分子式为C11H16,经测定数据表明,分子中除含苯环外不再含其它环状结
![]() 构,分子中还含有两个—CH3、两个─CH2─和一个-CH-。则该分子由苯环侧链异构所形成的同分异构体有
构,分子中还含有两个—CH3、两个─CH2─和一个-CH-。则该分子由苯环侧链异构所形成的同分异构体有
A.3种 B.4种 C.5种 D.6种
18.把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A.Al3+ B.Al(OH)3 C.AlO2- D.Al3+和Al(OH)3
19.将2 mol A和1 mol B通入一密闭容器中,在某温度下达到平衡:
2A(g)+B(g)![]() 2C(g)+D(g)。经测定,平衡时混合气体中气体C的体积分数为24%则B的转化率为
2C(g)+D(g)。经测定,平衡时混合气体中气体C的体积分数为24%则B的转化率为
A.73% B.36% C.24% D.12%
20.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液能与原来溶液完全一样的是
A.CuCl2 (Cu) B.NaOH (H2O)
C.NaCl (HCl) D.CuSO4 (Cu(OH)2)
(选择题答案请填入下表)
高二化学第一学期期末答卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第二卷 (非选择题共78分)
三、(本题包括2小题,共14分)
21.(8分)有下列反应.
①由乙烯制氯乙烷 ②苯与浓硫酸浓硝酸加热 ③乙炔使溴水褪色
④甲苯与酸性高锰酸钾溶液 ⑤由乙烯制聚乙烯 ⑥乙烷与氯气光照
其中属于取代反应的是___________;属于氧化反应的是____________;
属于加成反应的是_______________;属于聚合反应的是____________。
22.(6分)在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)![]() 3Z(气),已知加入1 molX和3molY,达到平衡后,生成a mol Z。
3Z(气),已知加入1 molX和3molY,达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入X mol。
四、(本题包括2小题,共25分)
23. (10分)在0.5mol/L纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是______________________;其原因是(用离子反应方程式和简
要文字说明):_____________________________________________________________;请再设计一个实验证明纯碱的水解是吸热的,方法是___________________________,现象是___________________________。
24.(15分)实验室制乙烯,常因温度过高而发生副反应,部分乙醇跟浓硫酸反应生成炭、二氧化硫、二氧化碳和水蒸气。
(1)写出制乙烯反应的化学方程式:__________________________________________。
![]()
![]()
![]()
 (2)用下图编号①~④的实验装置设计一个实验,验证上述反应混合气体中含有C2H4、CO2、SO2和H2O(气)。用装置的编号表示装置的连接顺序(按产物气流从左向右的流向): 。
(2)用下图编号①~④的实验装置设计一个实验,验证上述反应混合气体中含有C2H4、CO2、SO2和H2O(气)。用装置的编号表示装置的连接顺序(按产物气流从左向右的流向): 。
A B C
① ② ③ ④
A品红溶液 B浓品红溶液 C溴水
(3)实验时装置①中A瓶的现象 ,结论 ;若B瓶中
品红溶液不褪色,C瓶溶液褪色可得出结论________________,写出C瓶溶液
褪色的有关反应方程式_____________________________________。
(4)装置③中加的固体药品是 ,以验证混合气体中有 。
(5)装置②中盛的溶液是 __,以验证混合气体中有 。
五、(本题包括2小题,共19分)
25.(11分)下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质。
反应①②③都是置换反应,反应①在加热下②③在高温下进行。A在常温下为液态,C是有磁性的黑色晶体,F既能溶于NaOH又能溶于HCl。
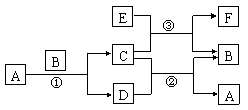 ⑴F的分子式为
⑴F的分子式为
⑵写出反应①的化学反应方程式
______
⑶写出E与浓强碱液反应的离子方程式
⑷写出反应③的化学方程式:
。
26.(8分)将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器中,根据下列不同情况,填写金属或金属离子。
(1)充分反应后,如果Fe有剩余,则容器中不可能有______________________________;
(2)充分反应后,如果容器中还有大量Fe3+剩余,则容器中一定含有________________,一定没有_______________;
(3)充分反应后,如果容器中还有大量Cu2+和Cu剩余,则容器中不可能有_____________。
六、(本题包括2小题,共20分)
27.(10分) 室温时20 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到室温,气体体积减少了50 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40
mL 。求气态烃的分子式。
28. (10分)在100ml 0.1mol/L的Al2(SO4)3溶液中加入0.5mol/L的NaOH溶液得到1.17g沉淀。求所加的NaOH溶液体积是多少毫升?