高二化学第一学期期末四校联考
命题人:云梦一中:周驹平 审题人:云梦一中:冷帆
注意事项:
1、本试卷分第I卷和第II卷两部分,第I卷为选择题,请将答案填入答题栏内;第II
卷为非选择题,请将答案直接写在各题对应要求的位置上,本试题满分120分,考试时间90分钟.
2、可能用到的相对原子质量:H 1 O 16 C 12 Al 27 Fe 56 Mg 24
Zn 65 Cu 64 Na 23 Cl 35.5
第I卷(选择题,共60分)
一、选择题(本题共12小题,每小题3分,共36分,每小题只有一个选项符合题意)
1、铁的冶炼在我国具有悠久的历史,最早约在
A 夏朝 B 商代 C 春秋 D 西汉
2、![]() 和
和 ![]() 的阳离子的核外电子数,前者与后者的关系
的阳离子的核外电子数,前者与后者的关系
A 大于 B 小于 C 等于 D 不能肯定
3、下列化合物不能直接由单质化合生成的是
① FeCl2 ② FeCl3 ③ FeS ④CuS ⑤ Al2S3
A ① B ③ ④ C ① ④ D ② ③ ⑤
4、定向爆破建筑物时,应同时定向切断钢筋和炸碎水泥,除要用适宜的炸药外,还需要
A氧炔焰 B 铝热剂 C 液氧 D 电弧
5、甲烷与氯气在光照条件下可发生取代反应,将等物质的量的反应物在光照条件下充分反应,得到的产物中哪种物质的物质的量最多的是
A CH3Cl B CH2Cl2 C CHCl3 D HCl
6、称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,如要使之放出等体积的气体(同温同压),则两份铝粉的质量之比为
A 1:2 B 3:2 C 1:3 D 1:1
7、在锌片、铜片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法正确的是
A 铜片是负极,铜片上有气体产生 B 电流方向是锌片流向铜片
C溶液中硫酸的物质的量减少 D 电解质溶液PH保持不变
8、在无色透明的强酸性溶液中,能大量共存的一组离子是
A NH4+ 、Al3+、NO3-、 SO42- B Na+、K+ 、Cl-、AlO2-
C Mg2+、K+、SO42-、MnO4- D Ca2+ 、Na+、HCO3-、OH-
(化学试卷·第1页·共6页)
9、在25℃时 0.01mol·L-1H2SO4 溶液中由水电离出的C(OH-) 约是
A 5×10-13 mol·L-1 B 1×10-12 mol·L-1
C 1×10-7 mol·L-1 D 1×10-2 mol·L-1
10、在含有NH4+、Fe3+、Al3+、Fe2+的稀溶液中加入足量的BaO固体,充分反应后,再加入过量的稀硝酸,完全反应后,原溶液的四种离子中数目有变化且增加的是
A NH4+ B Fe3+ C Al3+ D Fe2+
11、如图各烧杯中盛有海水,铁在其中腐蚀最慢的是
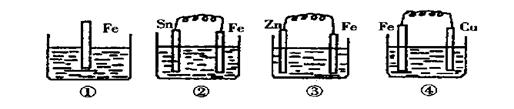
A ① B ② C ③ D ④
12 下列各组物质,若不用其它试剂,则无法鉴别的是
A MgCl2溶液和Na2CO3溶液 B AlCl3溶液和NaOH溶液
C NaAlO2溶液和盐酸 D 稀H2SO4和Na2CO3溶液
二、选择题(本题共6小题,每小题4分,共24分,每小题只有一个选项符合题意)
13、在含有Fe3+和Cu2+ 的溶液里、加过量铁粉,反应完全,滤出金属残渣,其质量恰好与加入铁粉的质量相等,则原混合溶液里的Fe3+与Cu2+ 的物质的量之比为
A 2:3 B 1:7 C 3:5 D 2:7
14、通入过量的Cl2于FeBr2溶液中,下列离子方程式正确的是
A 2Fe2++Cl2
![]() 2Fe3++2Cl-
B 2Fe2++4Br-+3Cl2
2Fe3++2Cl-
B 2Fe2++4Br-+3Cl2![]() 2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
C 2Fe2++2Br-+2Cl2 ![]() 2Fe3++Br2+4Cl- D 2Br-+Cl2
2Fe3++Br2+4Cl- D 2Br-+Cl2![]() Br2+2Cl-
Br2+2Cl-
15、进行一氯取代反应后,只能生成三种沸点不同的卤代产物的烷烃是
A (CH3)2CHCH2CH2CH3 B (CH3CH2)2CHCH3
C (CH3)2CHCH(CH3)2 D (CH3)3CCH2CH3
16、在一密闭容器中,用等物质的量的A和B发生如下反应:A(气)+2B(气)![]() 2C(气) 当反应达到平衡时,若混合物气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
2C(气) 当反应达到平衡时,若混合物气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
A 40% B 50% C 60% D 70%
17、已知常温下一种PH=3的酸和PH=11碱溶液等体积混合后,溶液呈酸性,其原因可能是
A 浓的强酸和稀的强碱溶液反应 B 浓的弱酸和稀的强碱溶液反应
C 等浓度的强酸和弱碱溶液反应 D 生成了一种强酸弱碱盐
18、将Mg、Al、Fe的单质分别投入质量相等的(且过量)稀H2SO4中,反应结束后,各溶液质量相等.则投入的Mg、Al、Fe的质量大小关系是
A 铝>镁>铁 B 镁>铝>铁 C铁>镁>铝 D 三者相等
(化学试卷·第2页·共6页)
第I卷选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 | ||||
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | ||||
| 得分 |
|
|
|
|
|
|
|
|
|
|
|
第II卷 (非选择题 共60分)
三、(本题包含2个小题 共18分)
19、(8分)对下列仪器回答问题 ①容量瓶 ② 园底烧瓶 ③滴定管
④量筒 ⑤烧杯 ⑥蒸发皿 ⑦分液漏斗 ⑧托盘天平.(用序号填空)
(1) 加热时必须垫石棉网的有________
(2) 使用时必须检查是否漏水的有________
(3) 其中标示出仪器使用温度的有________ .
(4) 一定标有"0"刻度的有__________
20、(共10分)
(1)(3分)某烷烃的结构简式如下,
CH3 CH3 C2H5
![]()
![]()
![]()
CH3-CH-CH-CH-CH2-C-CH3
![]()
![]()
C2H5 CH3 其名称为____________
(2)(4分)有① Cu ② CuSO4 ③ CuSO4·5H2O ④ NH3 ⑤ CH3COOH
⑥ BaSO4 ⑦Na2CO3 ⑧ HF ⑨ CHCl3 ⑩ NaOH等下列物质,
属于弱电解质的是_____.属于非电解质的是_____.(用序号填空)
(3)、(3分)在常温下,浓度均为0.1mol/L的下列溶液
①HCl ②H2SO4 ③CH3COOH ④ NaOH ⑤ Na2SO4
⑥ NH4Cl ⑦ Na2CO3 ⑧NH3·H2O
按PH值由大到小的顺序排列______________(用序号填空)
(化学试卷·第3页·共6页)
四、(本题包含2个小题共13分)
21、(4分)某无色透明混合气体可能含有NO、CO2、O2、Cl2、NH3和HCl等气体,将50mL该混合气体通过浓H2SO4,体积变为40mL,再通过NaOH溶液,体积变为20mL,此气体遇空气立即变为红棕色,此混合气体中含有__________ ;
其体积比为_______ 。
22、(9分)为了除去铝土矿中少量的SiO2和Fe2O3等杂质,得到纯净的Al2O3,其操作过程如下:分析下列各步操作,回答:(加入试剂均过量,且A、B为常见试剂)
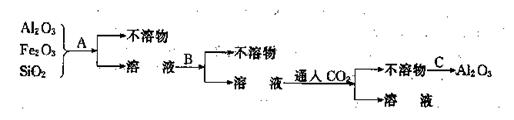
⑴ 试剂A为______ ,试剂B为______ .
⑵ 操作C为______ 。
⑶ 写出铝土矿中加入A试剂后发生反应的离子方程式
_____________________ ;
_____________________ .
五、实验(共2小题14分)
23、(5 分)某化工厂为消除所排出的废气中Cl2对环境的污染,将含Cl2的废气通过含铁单质的FeCl2溶液中即可有效地除去Cl2 ,
这一处理过程可用两个化学方程式表示为 ________________
_________________
处理过程中需定期添加的原料是 ____ 。
(化学试卷·第4页·共6页)
24、(9分)如图所示,该装置可用来制取和较长时间观察Fe(OH)2的颜色以及在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/LH2SO4 其它试剂任选.
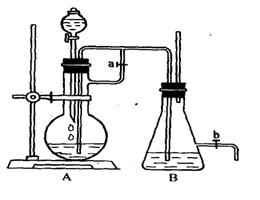
填写下列空白:
(1) B中盛有一定量的NaOH溶液,A中的烧瓶内应预先加入的试剂是____ ,
A中反应的离子方程式是_______________________
(2)为了较长时间观察Fe(OH)2的颜色,制取操作过程中有以下步骤或现象
①待反应一定时间关闭活塞a ; ② 在B瓶中出现白色絮状物;
③打开分液漏斗的活塞; ④FeSO4溶液被压入B瓶中;
⑤实验开始时先应将活塞a打开;
请用序号表示前后步骤或出现的现象:________________
(3)在B中较长时间能观察Fe(OH)2的白色絮状物,是因为B容器内没有____ (填化学式)的原故
(4)实验完毕后,打开活塞b(设B中最后液面不超过活塞b的支管口),取走B中的双孔塞,让空气进入,B中会呈现_____(填颜色)
其变化的化学方程式为_____________________ .
六、计算题 (本题包括2小题 共15分)
25、(7分) 将一定量的CH4 、O2和Na2O2放入一密闭容器中,用电火花不断引燃混合气体,使其充分反应.反应结束后,容器内压强趋于零,其残余固体溶于水无气体放出.
(1)有关Na2O2反应的化学方程式:
(2)CH4 、O2和Na2O2的物质的量之比是:
(3)若原容器内为0.1mol CH4 待反应后,向残余固体加入足量稀硫酸,可放出
______气体_________mol.
(化学试卷·第5页·共6页)
26、(8分) 100mL 1.0 mol/LAlCl3溶液中加入100mLNaOH溶液后,得到3.9 g沉淀,求NaOH溶液的物质的量浓度.

(化学试卷·第6页·共6页)
第一学期期末四校联考
高二化学参考答案
第一、二大题答案 (1~12 小题每题3分, 13~18 小题每题4分 )
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | C | C | B | D | D | C | A | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | A | D | B | D | A | B | A |
三、19、(1) ②⑤ (2) ①③⑦ (3) ①③④ (4) ③⑧ 每空2分
(多答一个序号倒扣1分,直至本小空的得分为零)
20、(1) 2、4、6、6-四甲基-3-乙基辛烷;(此空为3分)
(2) ⑤⑧;④⑨;(每空各2分)
(3)④⑧⑦⑤⑥③①② (序号全对为3分,错一个给2分,错二个本题为0分)
四、21 NH3、CO2、NO 1:2:2 。(每空各2分)
22、 (1) A为盐酸(或HCl) B为氢氧化钠溶液(或NaOH) (每空各2分)
(合理的强酸、强碱均可得分)
(2) 加热 (此空1分)
(3) Fe2O3
+6H+ ![]() 2Fe3+ +3H2O
2Fe3+ +3H2O
Al2O3+6H+ ![]() 2Al3+ +3H2O (每空各2分)
2Al3+ +3H2O (每空各2分)
五、
23、2FeCl2+Cl2![]() 2FeCl3
(2分) 2FeCl3+Fe
2FeCl3
(2分) 2FeCl3+Fe![]() 3FeCl2
(2分)
3FeCl2
(2分)
Fe (或铁) (1分)
24、(1) 铁屑;(1分) Fe + 2H+![]() Fe 2++ H2↑;(2分)
Fe 2++ H2↑;(2分)
(2) ⑤③①④② (2分)
(3) O2 (或空气) (1分)
(4) 红褐色; (1分) 4Fe(OH)2 +O2 +2H2O === 4Fe(OH)3 (2分)
六、
25
(1) 2Na2O2+2CO2![]() 2Na2CO3+O2 ;(1分)
2Na2CO3+O2 ;(1分)
2Na2O2+2H2O![]() 4NaOH+O2 (1分)
4NaOH+O2 (1分)
(2) 2:1:6 (2分)
(3) CO2 (或二氧化碳);(1分) 0.1 (2分)
(高二四校联考化学参考答案·第1页·共2页)
26、解:设NaOH溶液的物质的量浓度为C(NaOH)
n(AlCl3)=100mL×10-3L/mL×1.0mol/L=0.1mol
n[Al(OH)3]= ![]() = 0.05mol
= 0.05mol
∵ 0.1mol > 0.05mol
∴ 全部铝元素没有沉淀完毕,故加入碱量有两种情况:…………………(2分)
(1) 溶液中部分铝元素以Al3+ 存在 时;
AlCl3 + 3NaOH ![]() Al(OH)3↓+3NaCl
Al(OH)3↓+3NaCl
3 1
0.1L·C(NaOH) 0.05mol
列式:3×0.05mol = 1×0.1L·C(NaOH)
C(NaOH)=1.5mol/L …………………(3分)
(2) 溶液中部分铝元素以AlO2- 存在 时
AlCl3 + 3NaOH ![]() Al(OH)3↓ + 3NaCl
Al(OH)3↓ + 3NaCl
1 3 1
0.1mol 0.3mol 0.1mol
Al(OH)3 + NaOH
![]() NaAlO2
+ H2O
NaAlO2
+ H2O
1 1
(0.1-0.05)mol 0.05mol
共消耗 n(NaOH) =0.3mol+0.05mol=0.35mol
C(NaOH)= ![]() = 3.5mol/L ……………………(3分)
= 3.5mol/L ……………………(3分)
(高二四校联考化学参考答案·第1页·共2页)