高二化学第一学期期中考试试卷
(试卷满分100分,考试时间90分钟)
有关原子量:N—14 H—1 Cu—64 O—16 CI—35.5
一、选择题(只有一个答案正确)
1.下列物质中,氮元素显示的化合价相同的一组是( )
A. N2 NH3 B. NO2 N2O4
C . NO NH4NO3 D. N2O5 HNO2
2.下列说法中,不正确的是( )
A. 氮分子的结构为 N三N
B. 氮气在大气中的质量百分比为78%
C. 在足够的能量条件下,氮气可以和某些金属和非金属反应
D. 氮气可以代替稀有气体作焊接金属时的保护气。
3.下列变化中,需加入还原剂才能发生转化的是( )
A. N2→![]() B. N2→
B. N2→![]()
C.
NO→![]() D. NH3→NO
D. NH3→NO
4.下列氧化物中,属于硝酸酸酐的是( )
A.
NO B. ![]() C. N2O4 D. N2O5
C. N2O4 D. N2O5
5.下列几种盐中,受热分解只生成一种气体的是( )
A.![]() B. NH4CI C. NaHCO3 D. Cu(NO3)2
B. NH4CI C. NaHCO3 D. Cu(NO3)2
6.在下列反应中,硝酸既显酸性又显氧化性的是( )
A. 铜与浓硝酸 B. 氧化铜与稀硝酸
C.
碳与浓硝酸 D. 3P+5![]() +2H2O→3
+2H2O→3![]() +5NO
+5NO
7.一瓶浓硝酸呈黄色,这是因为( )
A.纯硝酸是黄色的
B.浓硝酸分解出的![]() 溶于硝酸
溶于硝酸
C.浓硝酸中含杂质FeCI3 D.试剂瓶是棕色的
8 .常温下,能放置在铁制容器中的是( )
A. 稀盐酸 B. 稀硫酸 C. 硫酸铜溶液 D. 浓硝酸
9.把浓硝酸、浓硫酸、浓盐酸分别滴在三张蓝色石蕊试纸上,这三张试纸最后依次呈现的颜色是( )
A. 红、黑、白 B. 白、黑、红 C. 红、红、红 D.白、红、红
10.下列各组离子在水溶液中能大量共存的是( )
A. S2-,NO3-,H+,Na+ B. NH4+,Na+,CI-,OH-
C. NO3-,NH4+,Na+,SO42- D. Cu2+,NO3-,OH-,K+
11.下列气体中,只能用排水法收集的是( )
A.
O2 B. ![]() C. NO D. H2
C. NO D. H2
12.下列各组气体中,都能用浓硫酸干燥,而且在常温下能大量共存的是( )
A.
N2和CO2 B.
![]() 和HCI
和HCI
C.
![]() 和H2 D. H2和F2
和H2 D. H2和F2
13.在下列可逆反应达到平衡后减小压强,平衡向正反应方向移动的是( )
A. N2(g)+O2(g)2NO(g)
B. 2![]() (g)N2O4(g)
(g)N2O4(g)
C. N2(g)+3H2(g)2![]() (g)
D. C(s)+H2O(g)CO(g)+H2(g)
(g)
D. C(s)+H2O(g)CO(g)+H2(g)
14.下列气体中无毒的是( )
A.CO B. CI2 C. ![]() D. N2
D. N2
15.下列物质中受热易分解,且其水溶液呈酸性的是( )
A.KNO3 B. NH4CI C. (NH4)2CO3 D. Na2CO3
16.能把Na2SO4, ![]() ,(NH4)2SO4,和
,(NH4)2SO4,和![]() 四瓶无色溶液加以区分(必要时可以加热)的一种试剂是(
)
四瓶无色溶液加以区分(必要时可以加热)的一种试剂是(
)
A. BaCI2溶液 B. NaOH溶液
C. AgNO3溶液 D. Ba(OH)2溶液
17.在8![]() +3CI2→6NH4CI+N2反应中,氧化剂和还原剂的物质的量之比是(
)
+3CI2→6NH4CI+N2反应中,氧化剂和还原剂的物质的量之比是(
)
A. 3:8 B. 8:3 C. 3:2 D. 3:1
18.下列气体能跟水发生氧化还原反应的是( )
A.NO B.![]() C.
C.![]() D.N2O5
D.N2O5
19.下列气体呈无色的是( )
A.溴蒸汽 B.氯气 C.氟气 D.氮气
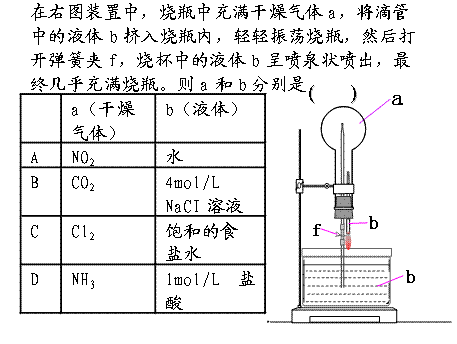 20.
20.
二、填空题
1.氮族元素位于元素周期表的________族,最外层都有_______个电子,按原子序数从小到大的顺序分别为__________,__________,_________,锑,铋;原子半径依次_______________,夺取电子的能力逐渐_______________,最高价氧化物对应水化物的酸性逐渐___________________.
2.某元素最高价氧化物的化学式是![]() ,则其气态氢化物的化学式是_______,该元素原子核外有3个电子层,最高价氧化物对应水化物的化学式是_________,则该元素是__________(写元素符号)。
,则其气态氢化物的化学式是_______,该元素原子核外有3个电子层,最高价氧化物对应水化物的化学式是_________,则该元素是__________(写元素符号)。
3.化学反应NaNO2(固)+NH4CI(饱和溶液)![]() NaCI+N2↑+2H2O来制取氮气,使用的气体发生装置与制取________、__________等气体相同,用____________法收集。
NaCI+N2↑+2H2O来制取氮气,使用的气体发生装置与制取________、__________等气体相同,用____________法收集。
4.氮气是一种__________色________味的气体,其分子的电子式为_________________结构式为____________, 氯化铵溶液和氢氧化钠溶液加热,其反应的化学方程式为_____________________________,
离子方程式为_________________________________。
5.对于平衡体系mA(g)+nB(s)pC(g)+qD(g),增大压强时(其他条件不变),C的含量减少,则m____________p+q(填<,= 或 >)
6.单质A能发生如下反应:
A 甲 乙 丙 丁 + 乙,
其中丁与铜反应还会生成乙,而且甲、乙、丙、丁中都含有相同的一种元素,甲可以作制冷剂,保护气,则A是_______,甲是________,乙是_________,丙是_________,丁是_________(写化学式)。
写出下列化学方程式:
A→甲____________________________________________________
甲→乙___________________________________________________
乙→丙___________________________________________________
丙→丁____________________________________________________
7.某无色澄清溶液中可能含有SO42-,CO32-,Cu2+,NH4+,CI-,Na+中的一种或几种,取少量该溶液于试管(1)中,滴入足量Ba(NO3)2溶液产生白色沉淀,待沉淀沉降后,取上层清液少量与试管(2)中,加入AgNO3溶液也产生白色沉淀,在两个试管中分别加入足量的稀![]() ,试管(1)内沉淀完全消失,试管(2)沉淀不变。取原溶液作焰色反应,火焰呈黄色,则该溶液中一定含有_____________________离子,一定没有__________________离子,可能含有_____________离子。写出有关反应的离子方程式___________________________,____________________.
,试管(1)内沉淀完全消失,试管(2)沉淀不变。取原溶液作焰色反应,火焰呈黄色,则该溶液中一定含有_____________________离子,一定没有__________________离子,可能含有_____________离子。写出有关反应的离子方程式___________________________,____________________.
三、配平氧化还原反应方程式,标出电子转移方向和数目
1._____KMnO4+____HCI(浓)→__KCI+_____MnCI2+_____CI2↑+_____H2O
氧化剂是______________,还原剂是_____________。
2._____FeCI3+_____H2S→_____FeCI2+_____S↓+_____HCI
氧化剂是______________,还原剂是__________________。
四、计算题
1、用氨氧化法制硝酸时,如果氨的利用率是80%,则用5吨氨可制得45%的硝酸多少吨?
2、1.92克铜跟400毫升2.5摩/升的稀![]() 充分反应后(铜都溶解)
充分反应后(铜都溶解)
(1) 产生气体的体积是多少?(标准状况下)
(2) 反应后溶液中NO3-的物质的量浓度是多少?(溶液体积变化忽略不计)
高二化学期中考试
答题纸
班级_____________姓名_____________学号________总分____________
一
| 1. | 2. | 3. | 4. | 5. |
| 6. | 7. | 8. | 9. | 10. |
| 11. | 12. | 13. | 14. | 15 |
| 16. | 17. | 18. | 19. | 20. |
二、
1.___________,______________,___________,________,__________,
__________________,______________________,_______________
2.____________,_____________,_______________。
3.____________,_____________,_________________________。
4.________________,___________,______________,_____________,
________________________________,____________________________
5._________________。
6.A _______,甲________,乙_________,丙_________,丁_________
A→甲____________________________________________________
甲→乙___________________________________________________
乙→丙___________________________________________________
丙→丁____________________________________________________
7.一定有_____________________,一定没有__________________,
可能有_____________。
有关反应的离子方程式:______________________________________,
___________________________________________________________.
三、
1._____KMnO4+____HCI(浓)→___KCI+_____MnCI2+_____CI2↑+_____H2O
氧化剂是_________还原剂是_____________。
2._____FeCI3+_____H2S→_____FeCI2+_____S↓+_____HCI
氧化剂是______________,还原剂是__________________。
四、
1.
2.
参考答案
一、40分(每小题2分)
1—5 B B B D C 6—10 A B D B C
11—15 C A D D B 16—20 D C B C D
二、38分(8小题写对一个离子给1分,其他每空各1分)
1.VA 氮 磷 砷 ;增大,减弱, 减弱
2.![]()
![]() P
P
3.CI2 HCI 排水取气法
4.略
5.<
6.N2 ,![]() ,NO,
,NO,![]() ,
,![]() 方程式略
方程式略
8.CO32- CI- Na+ ;SO42- Cu2+; NH4+ 离子方程式略
三、 12 分(电子转移方向和数目各1分,配平2分其他每空各1分)
1.2,16,2,2,5,8 KMnO4 HCI
2. 2, 1, 2, 1, 2 FeCI3 H2S
四、 10 分
1.32.9吨(4分)
2.0.448L ; 2.45mol/L(6分)
参考答案
一、40分(每小题2分)
1—5 B B B D C 6—10 A B D B C
11—15 C A D D B 16—20 D C B C D
二、38分(8小题写对一个离子给1分,其他每空各1分)
1.VA 氮 磷 砷 ;增大,减弱, 减弱
2.![]()
![]() P
P
3.CI2 HCI 排水取气法
4.略
5.<
6.N2 ,![]() ,NO,
,NO,![]() ,
,![]() 方程式略
方程式略
9.CO32- CI- Na+ ;SO42- Cu2+; NH4+ 离子方程式略
三、 12 分(电子转移方向和数目各1分,配平2分其他每空各1分)
1.2,16,2,2,5,8 KMnO4 HCI
2. 2, 1, 2, 1, 2 FeCI3 H2S
四、 10 分
1.32.9吨(4分)
2.0.448L ; 2.45mol/L(6分)