 高二化学
高二化学![]() 第一学期期中考试试卷6
第一学期期中考试试卷6
可能用到的相对原子质量:Cu:64 H:1 O:16 N:14
一、选择题(每小题只有一个正确选项,每小题2分,共40分)
1、实验室制取下列气体时,与实验室制氨气的发生装置相同的是: ( )
A、H2 B、O2 C、Cl2 D、CO2
2、下列气体中,不会造成空气污染的是 ( )
A、N2 B、NO C、NO2 D、CO
3、下列关于氮族元素的说法中不正确的是 ( )
A、原子的最外层均有5个电子,最高价均为+5价
B、非金属性比同周期的氧族元素和卤族元素弱
C、原子半径比同周期的氧族元素、卤族元素小
D、稳定性:NH3 > PH3
4、在实验室中,下列实际的保存方法正确的是①少量白磷保存在冷水中②Na、K保存在水里③HF溶液保存在塑料瓶中④AgNO3溶液保存在棕色细口瓶内⑤浓硝酸保存在棕色广口瓶内 ( )
A、①③④ B、②③④ C、①②③④ D、①②③④⑤
5、下列叙述不正确的是 ( )
A、NH3易液化,液氨常用作制冷剂
B、浓HNO3的氧化性强于稀HNO3
C、氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉处
D、稀HNO3和活泼金属反应时主要得到氢气
6下列含氧酸的酸性最强的是( )
A.HNO3 B.H3PO4
C.H3AsO4 D.H2CO3
7试管中盛有少量白色晶体,可能是铵盐,检验的方法是( )
- 加水,将湿润的红色石蕊试纸放在试管口
- 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
- 加氢氧化钠溶液,加热,滴入酚酞
- 加氢氧化钠溶液,加热,滴入紫色石蕊试剂
8、P2O5可用作干燥剂,但下列气体中不能用P2O5干燥的是: ( )
A、O2 B、HCl C、Cl2 D、NH3
9只用一种试剂,将(NH4)2SO4、NH4NO3、NaCl、K2SO4四种溶液区分开,这种试剂是:
A、NaOH溶液 B、AgNO3溶液 C、BaCl2溶液 D、Ba(OH)2溶液
10、常温下,能用铝制容器盛放的是: ( )
A、浓盐酸 B、浓硝酸 C、稀硝酸 D、稀硫酸
11、氮气常用作白炽灯泡中钨丝的保护气,这是因为( )
A.氮气难溶于水 B.氮气很不活泼
C.氮分子是非极性分子 D.氮气比空气轻
12下列溶液,不需要避光保存的是( )
A.AgNO3溶液 B.氯水 C.NaCl溶液 D.浓HNO3
13在一密闭容器中,有可逆反应X(g)+Y(g)![]() 2Z(g)+R(g),下列不能说明反应已达到平衡的是( )
2Z(g)+R(g),下列不能说明反应已达到平衡的是( )
A.X的生成速率与R的生成速率相同
B.容器内压强不随时间而变化
C.X、Y、Z、R浓度相等
D.X、Y、Z、R浓度不随时间而变化
14、在温度压强不变的情况下,已知N2O4![]() 2NO2,2mol N2O4在密闭容器内分解成NO2,达到平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是( )
2NO2,2mol N2O4在密闭容器内分解成NO2,达到平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是( )
A.1.8mol B.2.3mol C.2.2mol D.0.6mol
15下列各组离子中,可以大量共存的是( )
A.NH4+、Na+、Cl-、OH- B. Ba2+、H+、NO3-、SO42-
C.Ag+、NO3-、Cl-、K+ D. Mg2+、Cl-、K+、H+
16下列混合物可用加热方法分离的是( )
A.I2和NH4Cl B.BaCl2和NH4Cl
C.KClO3和MnO2 D.NH4Cl和NH4I
17氨气是工业上生产硝酸的主要原料,在氨气的催化氧化反应里,氨气表现的化学性质是( )
A. 碱性 B.氧化性 C. 还原性 D.不稳定性
18可逆反应A+3B![]() 2C+2D中C的起始的浓度是1.0mol/L,经30s后,它的浓度变成了0.4mol/L,在这30s内用B表示的平均反应速率是( )
2C+2D中C的起始的浓度是1.0mol/L,经30s后,它的浓度变成了0.4mol/L,在这30s内用B表示的平均反应速率是( )
A.0.03mol/L·S B. 0.02mol/L·S
C.0.06mol/L·S D.0.04 mol/L·S
19、下列关于硝酸的叙述正确的是: ( )
A、稀硝酸是弱酸,浓硝酸是强酸
B、铜与浓硝酸和稀硝酸都能反应生成二氧化氮
C、浓硝酸和稀硝酸都是强氧化剂
D、稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
20、对于在一固定容积容器中发生的反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应)下列措施中,既可加快反应速率,又可使平衡右移的是: ( )
2SO3(g)(正反应为放热反应)下列措施中,既可加快反应速率,又可使平衡右移的是: ( )
A、降温 B、减压 C、加催化剂 D、增加O2
二、选择题(每小题可能有一个或二个正确选项,每小题2分,共10分)
21.下列反应,硝酸既表现了酸性,又表现了氧化性的是
A.FeO+HNO3 B.Fe2O3+HNO3
C.SO2+HNO3 D.Cu+HNO3
22某溶液经分析除含大量H+外,还有Ba2+和Fe2+,则该溶液中还可能大量存在的离子是 ( )
A、SO42- B、OH- C、NO3- D、Cl-
23、各取0.1molCu分别投入到足量的下列四种酸中(必要时可加热):①浓硫酸②浓硝酸③稀硫酸④稀硝酸,充分反应后在相同条件下得到的气体体积由大到小的顺序是 ( )
A、②④①③ B、②①④③ C、①②④③ D、③④①②
24、下列各反应达到化学平衡后,加压或降温都能使化学平衡向正反应方向移动的是 ( )
A 2NO2![]() N2O4 (正反应为放热反应) B N2+3H2
N2O4 (正反应为放热反应) B N2+3H2![]() 2NH3(正反应为放热反应)
2NH3(正反应为放热反应)
C H2+I2(g)![]() 2HI(正反应为放热反应)D
C(S)+CO2
2HI(正反应为放热反应)D
C(S)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
25、向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+全部恰好氧化,并使X2O72-还原为Xn+,则n值为( )
A、2 B、3 C、4 D、5
三、填空(26、27、28、29题每空2分,30题每小题3分,共40分)
26、硝酸与金属反应时,主要是HNO3中+5价的氮______电子,被_______成较低价的氮的化合物,稀HNO3的还原产物一般是____ (填分子式,下同),浓HNO3的还原产物是________,王水是体积比为____的浓HNO3和浓HCl的混合物。
27、(1)实验室制NH3的反应方程式为_________________________
(2)氨的催化氧化是工业制取硝酸的基础,写出化学反应方程式。_________________________
(3)硝酸具有强氧化性,它能和许多物质发生反应。写出浓硝酸与非金属单质碳的反应方程式。_________________________
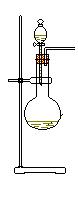
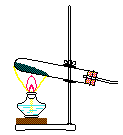
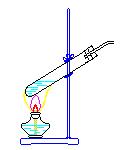 28、下图中,A、B、C是气体发生装置,D、E、F是气体收集装置。
28、下图中,A、B、C是气体发生装置,D、E、F是气体收集装置。
(A) (B) (C)
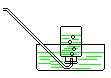 | |||||
(D) (E) (F)
试回答:若用NH4Cl和Ca(OH)2的混合物制取和收集氨气,应选用装置 ,(填字母)当将反应获得的氨气通入白滴板上的浓HCl时可以看到的现象是 ,解释这一现象的化学方程式为:
29、在一定条件下,下列反应达到化学平衡:H2(g)+I2(g)![]() 2HI(g)
2HI(g)
⑴如果升高温度,平衡混合物的颜色加深,则正反应是 反应(吸、放热)
⑵如果充入一定量的H2,则平衡_____移动,I2的转化率____,(增大、不变或减少、下同),
⑶如果增大气体的压强,则正反应速率____,逆反应速率____,平衡 移动。
30、配平下列氧化还原反应方程式
⑴__CuS+__HNO3—__Cu(NO3)2+__H2SO4+__NO+__H2O
⑵__KMnO4+__FeSO4+__H2SO4—__K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
四、 计算题(本小题10分,30题6分,31题4分)
31、在200mL2mol/L稀HNO3溶液中加入足量的铜粉,充分反应后,
⑴、反应后消耗Cu的质量是多少克?
⑵、产生标准状况下的NO气体体积是多少?
32、在一固定容积的密闭容器中,保持一定的温度,一定条件下发生:A(g)+2B(g)![]() 3C(g),已知加入1moLA和3moLB,且达到平衡后生成amoLC
3C(g),已知加入1moLA和3moLB,且达到平衡后生成amoLC
⑴达到平衡时,C在反应混合气中的体积分数是_______(用含a的代数式表示)
⑵相同条件下,若在同一容器中改为加入2moLA、6moLB,达到平衡后,C的物质的量为_______moL,此时C在反应混合气中的体积分数与原平衡相比_______(增、减、不变)
⑶相同条件下,若在同一容器中改为加入2moLA、8moLB,要求平衡后C在反应混合气中体积分数仍与原平衡相等,则还应加入C________moL。