高二化学第二学期期中考试卷4
本卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分.满分100分,考试用时90分钟.
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分,每小题只一个选项符合题意。)
1.2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氢化合物的叙述正确的是 ( )
A.碳氢化合物的通式为CnH2n+2 B.石油的主要成分是碳氢化合物
C.有机物都是碳氢化合物 D.碳氢化合物中的化学键都是极性键
2.下列做法会导致食品对人体有害的是 ( )
①在沥青公路上翻晒粮食 ②香肠中加过量亚硝酸钠以保持肉类新鲜
③用无烟煤直接烧烤鸡、鸭 ④用“瘦肉精”(一种含激素的饲料)喂养生猪
⑤用小苏打做发酵粉制面包 ⑥用乙烯催熟水果
A.①②③⑤ B.①②③④ C.②③④⑤ D.①②③④⑤
3.下列物质为纯净物的是 ( )
A.淀粉 B.聚氯乙烯
C.CH4与Cl2光照反应的生成物 D.冰醋酸
![]()
![]() 4.下列物质属于同系物的一组是 ( )
4.下列物质属于同系物的一组是 ( )
A.CH3Cl和CH2Cl2 B. 和
C.C10H22、CH4 D.淀粉和纤维素
5.关于乙烯分子结构的说法中,错误的是 ( )
A.乙烯分子里含有C=C双键
B.乙烯分子里所有原子共平面
C.乙烯分子中C=C双键键长和己烷分子中C-C单键的键长相等
D.乙烯分子里各共价键之间夹角约为120O
6.下列实验不需加热条件的是 ( )
A.制溴苯 B.催化裂化 C.制乙烯 D.酯化反应
7.下列化合物沸点比较错误的是 ( )
A.正戊烷>新戊烷>异戊烷 B. I2>Br2>Cl2
C.丙烷>乙烷>甲烷 D.一氯丁烷>一氯乙烷>一氯甲烷
8.某有机物的结构简式为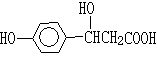 ,它可以发生的反应类型有 ( )
,它可以发生的反应类型有 ( )
(a)取代 (b)加成 (c)消去 (d)酯化 (e)水解 (f)中和 (g)加聚
A.(a)(c)(d)(f) B.(b)(e)(f)(h) C.(a)(b)(c)(d)(f) D.除(e)外
9.能发生银镜反应,并与丙酸互为同分异构体的是 ( )
A.乙酸甲酯 B.甲酸乙酯 C.丁醛 D.甲酸甲酯
10.表面发黑的红热铜丝插入到下列醇中,铜丝不能恢复光亮的是 ( )
A.(CH3)3CCH2OH B.(CH3) 2CHOH C.(CH3)3COH D.CH3OH
11.误服氯化钡溶液后会引起中毒,采用下列解毒方法中,正确的是 ( )
A.服用稀的硫酸铜溶液,使Ba2+变成BaSO4不溶物
B.服用小苏打溶液,使Ba2+变成BaCO3不溶物
C.服用大量豆浆,Ba2+能使蛋白质变性
D.饮用大量的水,使血液中凝聚的蛋白质重新溶解
12.下列有机物分子中所有原子一定在同一平面内的是 ( )
![]()
![]()
13.
对于烃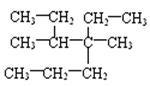 的命名正确的是
( )
的命名正确的是
( )
A.4—甲基—4,5—二乙基已烷 B.3—甲基—2,3—二乙基已烷
C.4,5—二甲基—4—乙基庚烷 D.3,4—二甲基—4—乙基庚烷
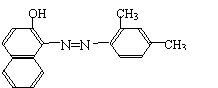 14.苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示,下列关于“苏丹红Ⅱ号”说法错误的是
14.苏丹红是许多国家禁止用于食品生产的合成色素,其中“苏丹红Ⅱ号”的结构简式如图所示,下列关于“苏丹红Ⅱ号”说法错误的是
A.能溶于苯
B.化学式为C18H16N2O
C. 属于甲苯的同系物
D.可以使酸性高锰酸钾溶液褪色
15.1mol金属钠与40g下列醇反应,放出氢气最少的是 ( )
A.乙醇 B.乙二醇
C.丙三醇 D.甲醇
16.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是 ( )
A.氯化铁溶液、溴水 B.碳酸钠溶液、溴水
C.酸性高锰酸钾溶液、溴水 D.酸性高锰酸钾溶液、氯化铁溶液
17.有机物甲可氧化生成羧酸,也可还原生成醇,由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是 ( )
A.甲分子中C的质量分数为40% B.甲在常温常压下为无色液体
C.乙比甲的沸点高 D.乙和甲的最简式相同
18.下列各组物质中各有两组份,两组份各取1摩尔,在足量氧气中完全燃烧,生成CO2 和H2O ,两者耗氧量不相同的是 ( )
A.乙酸和甲烷 B.乙烯和乙醇 C.丁烯和葡萄糖 D.乙炔和甲酸甲酯
19.下列有关除杂质(括号中为杂质)的操作中,错误的是 ( )
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.乙醇(水):加入足量生石灰,蒸馏,收集馏出物
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
20.某有机物甲经氧化后得乙(分子式为![]() ),而甲经水解可得丙,1 mol丙和2 mol乙反应得到一种含氯的酯(
),而甲经水解可得丙,1 mol丙和2 mol乙反应得到一种含氯的酯(![]() ),由此推断甲的结构简式为 ( )
),由此推断甲的结构简式为 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
21.两种气态烃以适当比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积是11 L.下列各组混合烃中不符合此条件的是 ( )
A.CH4 C3H8 B.C2H4 C4H10 C.C4H10 C3H6 D. C4H8 C3H8
22.3.42克蔗糖与3.24克淀粉混合并完全水解,共生成m克葡萄糖和n克果糖,则m︰n的值是 ( )
A 1︰3 B 1︰5 C 5︰1 D 3︰1
23.将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是 ( )
A.若将产物通过碱石灰,能被完全吸收;若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原产物气体的1/3
D.反应中消耗的氧气为56g
24.已知化合物A(![]() )与立方烷(
)与立方烷(![]() )的分子结构相似,如下图:
)的分子结构相似,如下图:

则![]() 的二氯代物的同分异构体数目为
( )
的二氯代物的同分异构体数目为
( )
A.3 B.4 C.5 D.6
25.毒品一直影响社会安定,吗啡和海洛因都是被严格查禁的毒品,已知吗啡的分子式是
C17H19NO3,海洛因是吗啡的二乙酸酯,则海洛因的分子式是 ( )
A.C21H22NO5 B.C21H27NO7 C.C21H23NO5 D.C21H23NO3
第Ⅱ卷(非选择题,共50分)
二、填空题(共12分。把正确答案填写在题中的横线上。)
26.(4分)按要求填空: —CH3_________(电子式),—NO2_____________(名称),
—OH_____________(名称), 羧基_______________(结构式)
27.(8分)2006年3月27日上午9时40分左右,嘉兴市秀洲区王店镇正峰化工贸易有限公司厂区2号混合苯储罐,因职工操作不当,导致灌装管道发生泄露,并引起爆炸。嘉兴119指挥中心接到报警电话后,立即调派13辆消防车、 80多名指战员到场扑救火灾。起火的2号储罐贮有4吨混合苯,该混合苯含95%的二甲苯和4%的甲苯。
(1)由于甲基位置不同,二甲苯有三种同分异构体,请写出它们的结构简式: 。
(2) 二甲苯、甲苯为易燃液体,其蒸气遇明火、强热就会引起燃烧爆炸,请写出甲苯燃烧的化学方程式: ;燃烧现象: 。
(3)三硝基甲苯是一种烈性炸药,它是由甲苯和浓硝酸、浓硫酸的混合溶液共热得到的;请写出该反应的化学方程式: 。
三、实验题(共10分。把正确答案填写在题中的横线上。)
28.(10分)某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的分子量,拟定的实验步骤如下:
① 准确量取该卤代烷b mL,放入锥形瓶中。
② 在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③ 反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀。
④ 过滤、洗涤、干燥后称重,得到固体c g。
回答问题:(1)装置中长玻璃管的作用是________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________离子。
(3)该卤代烷中所含卤素的名称是____________,判断的依据是_____________。
(4)该卤代烷的分子量是_____________(列出算式)。
(5)如果在步聚③中,加HNO3的量不足,没有将溶液酸化,则步骤④中测得的
c值(填下列选项代码)_______。
A.偏大 B.偏小 C.不变 D.大小不定
四、推断题(共22分。把正确答案填写在题中的横线上。)
29.(10分)科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们获得了1998年诺贝尔生理学或医学奖。请回答问题:
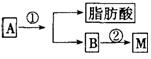 (1)已知M的分子量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,分子中C、N、O原子个数比为1:1:3。则M的分子式是________。D是双原子分子,分子量为30,则D的分子式为_________。
(1)已知M的分子量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,分子中C、N、O原子个数比为1:1:3。则M的分子式是________。D是双原子分子,分子量为30,则D的分子式为_________。
(2)油脂A经下列途径可得到M。
图中②的提示:C2H5OH+HO-NO2![]() C2H5O-NO2+H2O
C2H5O-NO2+H2O
硝酸 硝酸乙酯
反应②的化学方程式是 。
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式 。
(4)若将0.1molB与足量的金属反应,则消耗_______g金属钠。
 30.(12分)是重要的化式原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
30.(12分)是重要的化式原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知:
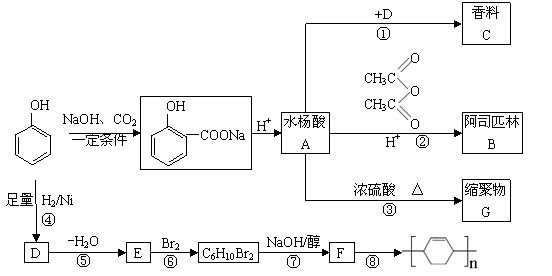 |
+ + CH3COOH
(1)写出C的结构简式 。
(2)写出反应③的化学方程式 。
(3)写出B的结构简式 。
(4)写出反应⑤的化学方程式 。
(5)写出反应类型:② ④ 。
五、计算题(共6分)
31.有机物A是烃的含氧衍生物,在相同条件下,A蒸气的质量是同体积乙醇蒸气的1.61倍。1.11克A完全燃烧后的产物,若通过碱石灰,则碱石灰质量增加2.79克;若通过五氧化二磷,则五氧化二磷质量增加0.81克。已知A能与金属钠反应放出氢气,也能与新制氢氧化铜(加热)反应生成红色沉淀。
(1)通过计算写出A的结构简式;
(2)求1.11克A与足量新制氢氧化铜共热,所得红色沉淀的质量。
高二化学第二学期期中考试答卷
班级 姓名 考号
原子量:H:1,C:12,N:14,O:16,Na:23,Mg:24,Al:27,S:32,Cl:35.5,Cu:64
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分,每小题只一个选项符合题意。)
请将正确答案涂在答题卡上
第Ⅱ卷(非选择题,共50分)
二、填空题(共12分。把正确答案填写在题中的横线上。)
26.(4分)—CH3 (电子式),—NO2 (名称),
—OH (名称), 羧基 (结构式)
27.(8分)
(1) 。(3分)
(2)化学方程式: ;
燃烧现象: 。(1分)
(3)化学方程式: 。
三、实验题(共10分。把正确答案填写在题中的横线上。)
28.(10分)
(1)装置中长玻璃管的作用是 。
(2)除去沉淀上吸附的 离子。
(3)卤素的名称是____________,
判断的依据是 。
(4)该卤代烷的分子量是 (列出算式)。
(5)步骤④中测得的c值(填下列选项代码) 。
A.偏大 B.偏小 C.不变 D.大小不定
四、推断题(共22分。把正确答案填写在题中的横线上。)
29.(10分)(1) M的分子式是 。D的分子式为 。
(2) 反应②的化学方程式是 。
(3)写出C所有可能的结构简式 。
(4)若将0.1molB与足量的金属反应,则消耗_______g金属钠。
30.(12分)(1)C的结构简式 。
(2)反应③的化学方程式 。
(3)B的结构简式 。
(4)反应⑤的化学方程式 。
(5)反应类型:② ④
五、计算题(共6分)
31. (1)
(2)