高二化学第二学期期中试卷(实验班)
本卷可能用到的原子量:
H 1 C 12 N 14 O 16 Na 23 Si 28 P 31 S 32 Cl 35.5 Cu 64
一.选择题(每小题只有一个答案,每题2分,共52分)
1.下列性质中,可以证明某化合物内一定存在离子键的是
A.溶于水 B.有较高的熔点 C.水溶液能导电 D.熔融状态能导电
2.下列分子的结构中,原子的最外层不能都满足8电子稳定结构的是
A.CO2 B.PCl3 C.CCl4 D.NO2
3.苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
4.用高能![]() 核轰击
核轰击![]() 核,发生核合成反应,得到新原子
核,发生核合成反应,得到新原子![]() ,该原子中中子数与核外电子数之差为
,该原子中中子数与核外电子数之差为
A.161 B.108 C.84 D.53
5.关于氢键,下列说法不正确的是
A.氢键比范德华力强,但它不属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高
C.由于氨与水分子之间可形成分子间氢键,使氨在水中溶解度增大
D.H2O是一种非常稳定的化合物,这是由于氢键所致
6.已知土壤胶粒带负电,因此在水稻田中,施用含氮量相同的下列化肥时,肥效最差的是
A.硫铵 B.碳铵 C.硝铵 D.氯化铵
7.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
A.该晶体属于原子晶体,其化学键比金刚石中的碳碳键更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
8.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是
H3XO4<H3YO4<H3ZO4,下列推断正确的是
A.元素的非金属性强弱:X>Y>Z B.气态氢化物稳定性:XH3<YH3<ZH3
C.原子半径:X<Y<Z D.水溶液的pH:Na3XO4<Na3YO4<Na3ZO4
9.某物质A在一定条件下加热分解,产物都是气体:2A=B+2C+3D,测得生成的混合气体对氢气的相对密度为15,则物质A的摩尔质量为
A.30 g·mol-1 B.60g·mol-1 C.90 g·mol-1 D.120g·mol-1
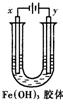 10.如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是
10.如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是
A.x是阳极,y是阴极
B.x极附近颜色变深,y极近颜色变浅
C.x是阴极,y极附近颜色加深
D.y是阴极,x极附近颜色加深
11.1克氢气燃烧生成液态水放出142.9 kJ热,表示该反应的热化学方程式正确的是
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ
C.2H2 + O2 = 2H2O; △H =-571.6 kJ
D.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8kJ
12.为消除碘缺乏病,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3-可和I-发生反应:IO3— + 5I- + 6H+ = 3I2 + 3H2O。根据此反应,可用试纸和日常生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
13.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A. Na+、Ba2+、Cl-、SO42- B. H+、NH4+、Al3+、SO42-
C. K+、AlO2-、NO3-、OH- D. H+、Cl-、CH3COO-、NO3-
14.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通人过量二氧化碳: Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
15.A、B、C是三种金属,根据下列①、②两个实验,确定它们的还原性强弱顺序为
① 当A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解。
② 电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。
A.A>B>C B.B>C>A C. C>A>B D.B>A>C
16.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
17.下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4含有P—P键的个数为4NA B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石和石墨中含有C—C键的个数相等 D.60gSi02中含Si—O键的个数为2NA
18.实验室测定CuSO4·5H2O晶体里结晶水的n值时,出现了三种情况:
①晶体中含有受热不分解的物质 ②晶体尚带蓝色,即停止加热 ③晶体脱水后放在台上冷却,再称量。使实验结果偏低的原因是
A.①② B.①③ C.②③ D.①②③
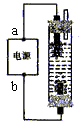 19.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使氯气被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
19.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使氯气被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
20.酸根![]() 所含电子数比硝酸根离子(
所含电子数比硝酸根离子(![]() )的电子数多10下列说法中正确的是
)的电子数多10下列说法中正确的是
A.R是第三周期元素
B.R元素的最高正价与N元素最高正价相同
C.![]() 和
和![]() 均只能被还原,不能被氧化
均只能被还原,不能被氧化
D.R和N两元素的单质都是空气的主要成分
21.两种短周期元素X和Y可组成化合物![]() ,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤
22.已知磷酸分子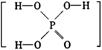 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是

23.CO2和NO的混合气体40mL,通过足量的Na2O2固体并充分反应后,同温同压下剩余气体的体积为20mL,则原混合气体中含NO的体积不可能是
A.10mL B.20mL C.15mL D.30mL
24.已知下列两个热化学方程式
2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJ
C3H8(g) +5O2(g) = 3CO2(g) + 4H2O(l);△H =-2220.0kJ
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是
A.1:3 B.3:1 C.1:4 D.1:1
25.在某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入1.92gCu粉微热,待充分反应后,溶液中Cu2+物质的量浓度约为
A.0.15mol/L B.0.3mol/L C.0.225mol/L D.无法计算
26..标况下将V L(摩尔质量为M g·mol-1)的气体A溶于100mL水中,得到溶液的密度是d g·mL-1,则此溶液物质的量浓度是
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1 C.
mol·L-1 C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
二.填空题(共34分)
27.(8分)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是_______;碱石灰的作用是______。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
<1>氨催化氧化的化学方程式是___________________________________________;
试管内气体变为红棕色,该反应的化学方程式是_____________________________。
<2>停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因___________________________________________
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
<1>两气体通入的先后顺序是________________,其理由是__________________________。
<2>氨气燃烧的化学方程式是_______________________________________________。
28.(6分)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可表述为:
![]() KClO3 + HCl(浓)
KCl + ClO2↑+ Cl2↑+
KClO3 + HCl(浓)
KCl + ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学和系数填入横线上)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
29.(5分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。下面是某些短周期元素的x值:
| 元素 | Li | Be | B | C | O | F | Na | A1 | Si | P | S | C1 |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)请你预测K元素与Na元素的x的大小关系_____________
(2)简述11-17号元素x值与原子半径的关系是
(3)x值的大小与元素的金属性或非金属性强弱之间的关系是_______________________
 (4)通过分析x值变化规律,确定Mg、N的x值范围:
(4)通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< .
30.(8分)由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
⑴ b电极材料应为____,电极反应式为________________。
⑵ 电解液C可以是__________。
A.纯净水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶ d为苯,其作用是______________,在加入苯之前对C应作何简单处理___________
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是________。
A.改用稀硫酸作电解液 B.适当增大电源的电压。
C.适当减小两电极间距离 D.适当降低电解液的温度。
⑸ 若C中用Na2SO4溶液,当电解一段时间看到白色Fe (OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为_____________________。
31.(7分)请用图中的装置设计一个实验以测定SO2转化为SO3的转化率:
|
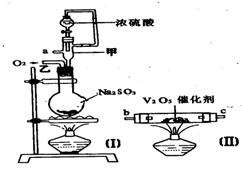
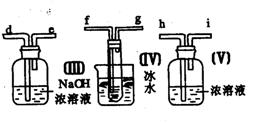
(1)这些装置的连接顺序(按气体从左到右的方向)是
____→ ____→____ →_____→____→____→_____→______→(填各接口的编号)。
(2)实验时甲装置的作用是________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是__________________。
(4)(Ⅳ)处观察到的现象是________________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为__________。
 三.计算题(共14分)
三.计算题(共14分)
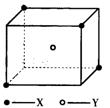
32.(7分)某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每个X同时吸引着__________个Y,该晶体的化学式为__________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________。
33.(7分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的相对分子质量以17.0计,水的密度以1.00 g/cm3计)
第二学期高二化学期中试卷(实验班)
一,选择题(每小题只有一个答案,每题2分,共52分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
二.填空题(共34分)
27.(8分)
(1)大试管内碳酸盐的化学式是_________________;碱石灰的作用是________________。
(2)<1>氨催化氧化的化学方程式是___________________________________________;
试管内气体变为红棕色,该反应的化学方程式是_____________________________。
<2>原因__________________________________________________________
(3)<1>两气体通入的先后顺序是_____________________,其理由是___________________。
<2>氨气燃烧的化学方程式是_______________________________________________。
28.(6分)
![]() (1) KClO3
+ HCl(浓)
KCl + ClO2↑+ Cl2↑+
(1) KClO3
+ HCl(浓)
KCl + ClO2↑+ Cl2↑+
(2)浓盐酸在反应中显示出来的性质是_______
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)消毒的效率是Cl2的_______倍。
29.(5分)
(1)请你预测K元素与Na元素的x的大小关系__________________________
(2)简述11-17号元素x值与原子半径的关系是
(3)x值的大小与元素的金属性或非金属性强弱之间的关系是______________________________
(4) <x(Mg)< , <x(N)< .
30.(8分)
⑴ b电极材料应为__________,电极反应式为_____________________________。
⑵ 电解液C可以是_____________________________________________。
⑶ d为苯,其作用是______________,在加入苯之前对C应作何简单处理___________
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是_____________________。
⑸ 混合物中另一明显现象为___________________________________________。
31.(7分)
(1)这些装置的连接顺序(按气体从左到右的方向)是
____→ ____→____ →_____→____→____→_____→______→(填各接口的编号)。
(2)实验时甲装置的作用是______________________________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是_____________________________________________________。
(4)(Ⅳ)处观察到的现象是__________________________________________________________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_______________________________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为________________________________。
 三.计算题(共14分)
三.计算题(共14分)
32.(7分)
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________。
33.(7分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的相对分子质量以17.0计,水的密度以1.00 g/cm3计)